
 .
.分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N;F元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,则F为S;D与A同主族,且与F同周期,则D为Na;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,然后利用元素及其单质、化合物的性质来解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A为H;B元素的最高价氧化物对应水化物与其氢化物能生成盐,则B为N;F元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$,则F为S;D与A同主族,且与F同周期,则D为Na;A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的多种化合物,则C为O,
(1)B是氮元素、E是铝元素,故答案为:氮;铝;
(2)C为O元素,D为Na元素,形成的原子个数比为1:1的化合物Na2O2,电子式为 ,
,
故答案为: ;
;
(3)单质越容易与氢气反应,氢化物的还原性越强,元素的非金属性越强,单质的熔点属于物理性质,不能比较非金属性强弱,故②③正确、①错误,
故答案为:②③;
(4)H、O、Na、S四种元素可以形成两种酸式盐(均由四种元素组成)分别为NaHSO3、NaHSO4,二者相互反应的离子方程式为:H++HSO3-=SO2↑+H2O,
故答案为:H++HSO3-=SO2↑+H2O;
(5)H、O、S间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲为HS-,乙为OH-,则甲与乙反应的离子方程式为:HS-+OH-=S2-+H2O,
故答案为:HS-+OH-=S2-+H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,难度不大,注意掌握电子式书写及常见10电子、18电子微粒.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4和SiCl4的熔点 | |
| B. | 邻羟基苯甲醛( )和对羟基苯甲醛( )和对羟基苯甲醛(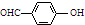 )的沸点 )的沸点 | |
| C. | HF和HCl在水中的溶解度 | |
| D. | H2SO3和H2SO4的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
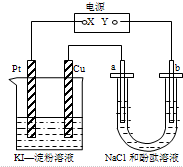
| A. | X可以是电源的负极,也可以是电源的正极 | |
| B. | 甲装置的电池反应是:2Cu2++4I-=2CuI↓+I2 | |
| C. | 乙装置a电极周围溶液变红色,pH变大 | |
| D. | 乙装置中Na+向b电极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 元素周期表是学习化学的重要工具,右图是元素周期表中的一格,以下获取的信息错误的是( )
元素周期表是学习化学的重要工具,右图是元素周期表中的一格,以下获取的信息错误的是( )| A. | 该元素的原子序数是53 | B. | 该元素属于金属元素 | ||
| C. | 该元素的原子核外有53个电子 | D. | 该元素的相对原子质量为126.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含0.05NA个溴分子的CCl4溶液可以和1.12L乙烯恰好完全反应 | |
| B. | 标准状况下,11.2L的氯气分子参加氧化还原反应,转移的电子数目不一定是NA个 | |
| C. | 将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积大约为22.4L | |
| D. | 16gCH4与19gH3O+所含有的质子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com