
【题目】C、Si是构成无机非金属材料的重要元素。
(1)Si在周期表中的位置为_____________。
(2)为比较C、Si的非金属性,某同学设计了如下实验:

装置①中盛放的试剂是________,装置②中发生反应的离子方程式是_____________。
(3)SiC是一种重要的高温耐磨材料。SiC中,C元素显________(填“正”或“负”)化合价,从原子结构角度解释原因是__________________。
【答案】
(1)第三周期IVA族;
(2)饱和NaHCO3溶液;CO2+H2O+SiO32-=H2SiO3↓+CO32-;
(3)负;C、Si均位于IVA族,从上到下原子半径逐渐增大,原子核对最外层电子吸引能力逐渐减弱,元素非金属减弱
【解析】
试题分析:(1)Si是14号元素,在周期表中位于第三周期IVA族,故答案为:第三周期IVA族;
(2)要为比较C、Si的非金属性,可以根据最高价氧化物的水化物的酸性强弱比较。装置①生成的二氧化碳中混有少量氯化氢,可以选用饱和NaHCO3溶液除去,装置①中盛放的试剂是饱和NaHCO3溶液,装置②发生反应的离子方程式为CO2 + H2O + SiO32-=H2SiO3↓+ CO32-,故答案为:饱和NaHCO3溶液;CO2 + H2O + SiO32-=H2SiO3↓+ CO32-;
(3)SiC是一种重要的高温耐磨材料。在SiC中,C、Si均位于IVA族,从上到下原子半径逐渐增大,原子核对最外层电子吸引能力逐渐减弱,元素非金属减弱,C的非金属性比硅强,显负化合价,故答案为:C、Si均位于IVA族,从上到下原子半径逐渐增大,原子核对最外层电子吸引能力逐渐减弱,元素非金属减弱。


科目:高中化学 来源: 题型:
【题目】某同学用下图装置及药品进行酸性强弱的实验,下列说法不正确的是
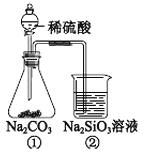
A. ①和②中发生的反应均为复分解反应
B. 若将实验中的稀硫酸换成稀盐酸也能比较三种酸强弱
C. 一段时间后②中有胶冻状物质生成
D. 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂,用最简单的方法鉴别下列物质:
①NaOH溶液,②Mg(NO3)2溶液,③CuSO4溶液,④KCl溶液,正确的鉴别顺序是
A. ①②③④ B. ③④②① C. ④①②③ D. ③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.有的共价化合物在液态时也能导电
B.含有离子键的化合物中,也可能还含有共价键
C.形成离子键的微粒必须是金属阳离子与阴离子
D.非金属元素形成的化合物一定不存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
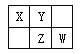
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按电子排布,可把周期表里的元素划分成5个区,电子构型为[Xe]4f145d76s2的元素位于周期表中的哪个区( )
A. s区 B. d区 C. f区 D. ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为短周期元素的一部分,请参照元素①~⑧在表中的位置,回答下列问题。
① | ||||||
② | ③ | ④ | ||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)元素⑦在元素周期表位置是________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)。________________________
(3)④、⑤、⑥的离子半径由大到小的顺序为(填元素符号)_______________。
(4)由①和④组成的元素质重比为1:8的化合物的电子式是_________。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为。______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式____ 。
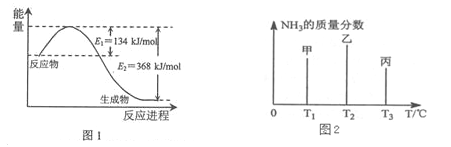
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如图2所示:
此时甲、乙、丙三个容器中一定达到化学平衡状态的是 容器,都达到平衡状态时,NH3的质量分数最高的是 容器(填甲、乙、丙)。
下图3是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)=0.10 mol/L,c(H2) = 0.26 mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示。
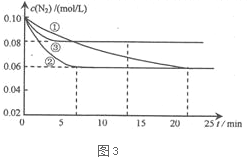
Ⅰ该反应实验②平衡时H2的转化率为 。
Ⅱ据图3所示,②装置中有一个条件与①不同,请指出②相对①改变的条件 。
Ⅲ计算实验③的平衡常数为___________________。
(3)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO +NO2 +H2O(方程式未配平)。3.2 g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素的某些性质如表所示(其中只有W、Y、Z为同周期元素)下列说法正确的是( )

A. 由Q与Y形成的化合物中只存在离子键 B. Z与X之间形成的化合物具有还原性
C. 由X、Y、Z三种元素形成的化合物,一定是共价化合物 D. Y与W形成的化合物中,Y显负价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com