
| A. | 43.2 g | B. | 46.8 g | C. | 53.6 g | D. | 63.8 g |
分析 Mg、Cu在反应中失去电子,最终生成Mg(OH)2、Cu(OH)2,则可知失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,根据生成NO的气体的物质的量,可知反应中转移电子的物质的量,结合氧化还原反应得失电子数目相等,可知最终生成沉淀的质量.
解答 解:反应中Cu$\stackrel{-2e-}{→}$Cu2+$\stackrel{2OH-}{→}$Cu(OH)2,Mg$\stackrel{-2e-}{→}$Mg2+$\stackrel{2OH-}{→}$Mg(OH)2,
可知Mg、Cu在反应中失去电子的物质的量等于生成沉淀需要氢氧根离子的物质的量,
根据HNO3$\stackrel{+3e-}{→}$NO,
生成8.96LNO转移的电子为$\frac{8.96L}{22.4L/mol}$=1.2mol,
所以反应后生成沉淀的质量为26.4g+1.2mol×17g/mol=46.8g.
故选B.
点评 本题考查混合物的计算,题目难度中等,本题注意把握电子转移的数目和氢氧根离子之间的关系,为解答该题的关键.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
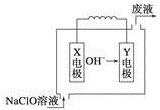 燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )
燃料电池具有能量转化率高、无污染等特点,下图为Mg-NaClO燃料电池结构示意图,下列说法正确的是( )| A. | 电池工作时,Na+向负极移动 | |
| B. | 镁作Y电极 | |
| C. | 废液的pH大于NaClO溶液的pH | |
| D. | X电极上发生的反应为ClO-+2H2O-4e-═ClO3-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的燃烧热为283 kJ | |
| B. | 图可表示由CO生成CO2的反应过程和能量关系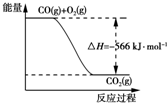 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452 kJ•mol-1 | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的二氧化硫和氨气,前者体积大 | |
| B. | 标况下22.4升 HCl通入水中溶液中含氯化氢分子为0.1 mol | |
| C. | 任何条件下相同物质的量的两种气体含有相同数目的分子 | |
| D. | 标况下2 molH2的摩尔质量是4g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Y | V | |||
| X | W |
| A. | 原子半径:X>W>V>Y | |
| B. | Y的最高价氧化物的电子式为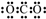 | |
| C. | X的最高价氧化物能与V、W最高价氧化物对应的水化物反应 | |
| D. | 甲、乙混合时所生成的白烟为离子化合物,只含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的周期性变化 | B. | 电负性的周期性变化 | ||
| C. | 第一电离能的周期性变化 | D. | 原子核外电子排布的周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
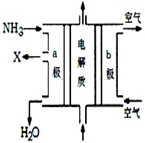 以下是对化学反应变化过程及结果的研究.按要求回答问题:
以下是对化学反应变化过程及结果的研究.按要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com