

分析 (1)装置甲中是空气中的二氧化碳与氢氧化钠反应生成碳酸钠与水;
(2)乙装置反应结束后,装置中含有二氧化碳,不将二氧化碳排尽,会使测定的二氧化碳的质量偏小,故反应后应再通空气,排尽装置内的二氧化碳,使之被丁装置吸收;
(3)由题意可知,反应生成的二氧化碳的质量为(w-m)g,计算二氧化碳的物质的量,根据碳元素守恒二氧化碳的物质的量等于样品中碳酸钠的物质的量,计算样品中碳酸钠的质量,再利用质量分数的定义计算;
(4)从装置乙中产生导出的气体中含有水,如果不除去气体中的水,会使丁中测定的二氧化碳的质量增大;
(5)空气中二氧化碳、水蒸气进入丁中影响二氧化碳的质量测定,导致测定二氧化碳的质量增大;
解答 解:(1)装置甲中二氧化碳与氢氧化钠反应生成碳酸钠与水,反应的离子方程式为CO2+2OH-=CO32-+H2O,
故答案为:CO2+2OH-=CO32-+H2O;
(2)乙装置反应结束后,装置中含有二氧化碳,不将二氧化碳排尽,会使测定的二氧化碳的质量偏小,故反应后再通空气,排尽装置内的二氧化碳,使之全部被丁装置吸收,
故答案为:将生成的CO2完全排出到丁中;
(3)由题意可知,反应生成的二氧化碳的质量为(w-m)g,二氧化碳的物质的量为$\frac{(w-m)g}{44g/mol}$=$\frac{w-m}{44}$mol,根据碳元素守恒可知样品中碳酸钠的物质的量为$\frac{w-m}{44}$mol,样品中碳酸钠的质量为$\frac{w-m}{44}$mol×106g/mo=$\frac{53(w-m)}{22}$g,样品中碳酸钠质量分数为$\frac{\frac{53(w-m)}{22}}{n}$×100%=$\frac{53(w-m)}{22n}$×100%,
故答案为:$\frac{53(w-m)}{22n}$×100%;
(4)从装置乙中产生导出的气体中含有水,如果不除去气体中的水,会使丁中测定的二氧化碳的质量增大,导致测定的样品中碳酸钠的质量增大,测定的碳酸钠质量分数偏大,
故答案为:偏大;
(5)空气中二氧化碳、水蒸气进入丁中影响二氧化碳的质量测定,导致测定二氧化碳的质量增大,在丁后面还要再连一个跟丁一样的装置戊装置的作用是吸收二氧化碳中的水蒸气,防止进入装置丁中,
故答案为:防止空气中的H2O和CO2进入装置丁.
点评 本题考查学生对实验原理及装置理解、对操作的评价、物质含量的测定、化学计算等,难度中等,根据物质的化学性质,要认真分析,把握实验设计的每个步骤中的实验目的.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | B. | 所得的分散系中的分散质为Fe2O3 | ||
| C. | 给分散系通电时阳极周围黑色不变 | D. | 该分散系能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L醋酸 | B. | 0.5L0.1mol/L氯化钠溶液 | ||
| C. | 0.1L0.1mol/L硫酸钠溶液 | D. | 2L0.1mol/L磷酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
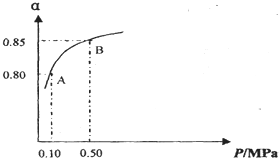
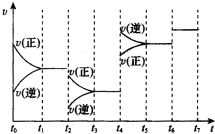
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题.
4种相邻主族短周期元素的相对位置如表,元素X的核外电子数是元素M的2倍,Y的氧化物具有两性,回答下列问题.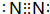 ,气体分子(MN)2的电子式:
,气体分子(MN)2的电子式: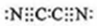 ,X形成的离子的电子式:Mg2+.
,X形成的离子的电子式:Mg2+.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
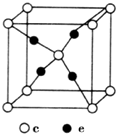 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 |  |  |  | |
| 添加试剂 | 10.0mlFeSO4溶液 | 10.0mlFeSO4溶液+2ml煤油 | 10.0mlFeSO4溶液+1.0铁粉 | 10.0mlFeSO4溶液+ 少量(或几滴)硫酸 |
| 3天内的现象 | 溶液颜色很快变成黄色,并出现棕黄色浑浊 | / | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com