
【题目】下列有关物质的性质与用途不具有对应关系的是
A.CaO能与水反应,可用作食品干燥剂
B.ClO2具有较强的氧化性,可作为自来水的消毒剂
C.NaHCO3能与碱反应,因此食品工业用小苏打做焙制糕点的膨松剂
D.还原铁粉具有较大的表面积和较强的化学活性,可用作富脂类食品的脱氧剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在硫酸铜溶液中加入碘化钾溶液,有白色沉淀生成,溶液的颜色则由蓝色变为深黄色,经分析证明白色沉淀是碘化亚铜。表示这个氧化还原反应的离子方程式是
A.Cu2++3I-=CuI↓+I2B.Cu2++2I-=Cu++I2
C.2Cu2++2I-=2Cu++I2D.2Cu2++4I-=2CuI↓+I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半,U的最高化合价和最低化合物的代数和为6;R和Q可形原子数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应.请回答下列问题:
(1)T元素在期表中的位置是________;由上述元素中的四种元素形成的既含有离子键又含有共价键的化合物为________(写出其中一种物质的名称).
(2)X、Z、Q三种元素的原子半径由小到大顺序为________(填元素符号).
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为________.
(4)下列可以判断R和T金属性强弱的是________(填序号).
a.单质的熔点R比T低 b.单质与酸反应时,失电子数R比T少
c.单质与水反应R比T剧烈 d.最高价氧化物的水化物的碱性R比T强
(5)某同学用Q、R两元素的单质反应生成固体物质R2Q2,R2Q2属于离子化合物,且能与化合物X2Q反应生成Q的单质.R2Q2的电子式为________;R2Q2与X2Q反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中烧杯里盛的是天然水,铁被腐蚀由快到慢的顺序是( )
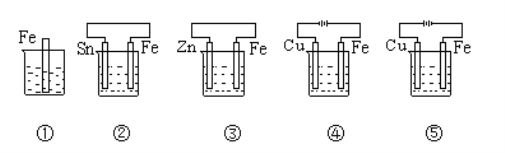
铁被腐蚀由快到慢的顺序是
A. ③〉②〉①〉④〉⑤ B. ④〉②〉①〉③〉⑤
C. ③〉②〉④〉⑤〉① D. ④〉⑤〉②〉③〉①
查看答案和解析>>
科目:高中化学 来源: 题型:
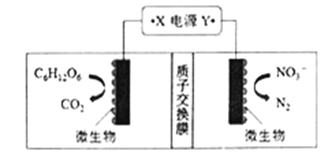
【题目】(1)世界水产养殖协会介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。请写出阴极的电极反应式 _________________________。
(2)甲醇可利用水煤气合成:CO(g)+2H2(g) ![]() CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是___________。
CH3OH(g) △H<0. 一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变温度或压强时,平衡后CH3OH的体积分数 φCH3OH)变化趋势如图所示。下列说法正确的是___________。
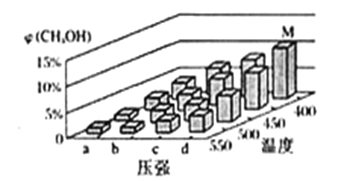
A.状态M,平衡时的CO转化率为10%
B.图中压强的大小关系是a<b<c<d
C.恒温恒压时,在原平衡体系中再充入适量甲醇,重新平衡后体系中甲醇的体积分数不变
D.当体系中 n(CO)/n(H2)的值不随时间变化时,体系达到平衡
(3)二氧化硫和碘水会发生如下二步反应:
反应 | 活化能 | |
第一步 | SO2+I2+2H2O | 9.2kJ·mo1-1 |
第二步 | I2+ I— | 23.5kJ·mo1-1 |
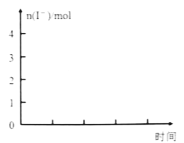
一定条件下,1mol SO2分别加入到体积相同、浓度不同的碘水中,体系达到平衡后,H+、I3—、SO42—的物质的量随n(I2)/n(SO2)的变化曲线如图 (忽略反应前后的体积变化)。

①有人认为X点的I—浓度小于Y点,你认为该观点是否正确________,原因是_________________。
②当n(I2)/n(SO2)=4时,请在下图画出体系中n (I—)反应时间的变化曲线。________
③化学兴趣小组拟采用下述方法来测定I2+I—![]() I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
I3—的平衡常数(室温条件下进行,实验中溶液体积变化忽略不计):
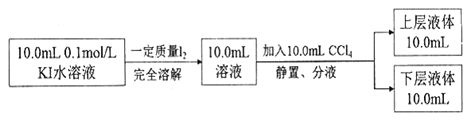
已知:I—和I3 —不溶于CCl4;:一定温度下,碘单质在四氯化碳和水混合液体中,碘单质的浓度比值 ![]() 即是一个常数(用Kd表示,称为分配系数),室温条件下 Kd=85。实验测得上层溶液中c(I3 —)=0.049mol/L,下层液体中c(I2)=0.085mol·L-1。结合上述数据,计算室温条件下I2+ I—
即是一个常数(用Kd表示,称为分配系数),室温条件下 Kd=85。实验测得上层溶液中c(I3 —)=0.049mol/L,下层液体中c(I2)=0.085mol·L-1。结合上述数据,计算室温条件下I2+ I—![]() I3—的平衡常数K=_______(保留三位有效数字)。
I3—的平衡常数K=_______(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+Q达到平衡,下列说法正确的是
2C(g)+Q达到平衡,下列说法正确的是
A. 加压,v(正)、v(逆)都增大,增大倍数v(正)小于v(逆)
B. 降温,v(正)、v(逆)都减小,减小倍数v(正)小于v(逆)
C. 使用催化剂,v(正)、v(逆)都改变,变化的倍数不同
D. 扩大容器体积,容器内A、B、C物质的量都减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com