
| A、溶液中难以确定Cl-的存在与否 |
| B、原溶液中所含的离子为:Fe2+、K+、NO3-、SO42- |
| C、步骤②中可以确定Fe2+、NO3-的存在,不能确定其它离子是否存在 |
| D、步骤③中的白色沉淀为2种钡盐 |


科目:高中化学 来源: 题型:
 氟元素半径小,电负性高,可与金属或非金属生成最高价化合物,如MnF2、SF6等.
氟元素半径小,电负性高,可与金属或非金属生成最高价化合物,如MnF2、SF6等.查看答案和解析>>
科目:高中化学 来源: 题型:
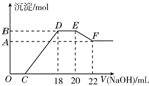 探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.
探究实验发现,硝酸发生氧化还原反应时,浓度越稀,对应还原产物中氮元素的化合价越低.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M>N | B、M<N |
| C、M=N | D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质焰色反应呈黄色,结论:该物质是钠盐 |
| B、无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3 |
| C、无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42- |
| D、无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到平衡时,SO2的浓度与SO3的浓度相等 |
| B、相同状况下,反应2SO3(g)?2SO2(g)+O2(g)是一个吸热反应 |
| C、在密闭容器中加入2molSO2和1molO2充分反应后放出197KJ的热量 |
| D、升高温度,吸热反应的速率增大,放热反应的速率减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
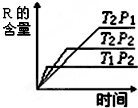 在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L,反应符合右图.下列叙述正确的是( )
在密闭容器中进行下列反应:M(g)+N(g)R(g)+2L,反应符合右图.下列叙述正确的是( )| A、T2>T1,正反应放热,L是液体 |
| B、P2<P1,正反应吸热,L是固体 |
| C、T2<T1,正反应放热,L是气体 |
| D、P2>P1,正反应吸热,L是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、对煤进行脱硫、液化、气化加工,提高煤的综合利用率 |
| B、研究以植树秸秆为原料制取生物柴油 |
| C、为加快融雪,在高速路面上大范围使用融雪剂 |
| D、进行以“设计绿色化工工艺,提高原子利用率”为目标的技术革新 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、Cl-、OH- |
| B、Fe2+、H+、SO42-、NO3- |
| C、Na+、Mg2+、Cl-、CO32- |
| D、K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com