
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
C(CH3OH)
| ||
C(H2)?C(CO)
|
0.04
| ||
0.02×0.01
|


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
| A、NaHCO3溶液与NaOH溶液反应:OH-+HCO3-=CO2↑+H2O |
| B、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| C、氢氧化钠溶液吸收过量的二氧化碳:2OH-+CO2=CO32-+H2O |
| D、铝与氢氧化钠溶液反应:Al+OH-+H2O=AlO2-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.
已知A、B、C、D、E五种短周期的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子最外层电子数是次外层的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
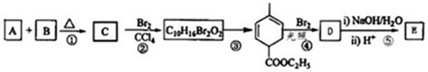
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
滴定次数 | 待测氢氧化钠溶液 的体积(ml) | 0.100mol/L醋酸的体积 | |
| 滴定前的刻度(ml) | 滴定后的刻度(ml) | ||
| 第一次 | 25.00 | 0.00 | 24.98 |
| 第二次 | 25.00 | 1.56 | 27.86 |
| 第三次 | 25.00 | 0.22 | 25.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
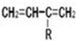 、CH2=CH2可以用键线式
、CH2=CH2可以用键线式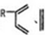 表示,两者可以发生如下反应:
表示,两者可以发生如下反应: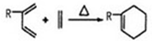 试回答下列问题:
试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X、Y、Z互为同分异构体 |
| B、X、Z均能与FeCl3溶液发生显色反应 |
| C、X、Y、Z分子中均含有2个手性碳原子 |
| D、1molX与NaOH溶液反应最多消耗3molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com