
【题目】已知2H→H2放出437.6 kJ的热量,下列说法正确的是( )
A.氢气分子内每个氢原子都达到了8电子稳定结构
B.1 mol H2的能量比2 mol H的能量低
C.1 mol H2离解成2 mol H要放出437.6 kJ热量
D.氢原子不如氢分子活泼
科目:高中化学 来源: 题型:
【题目】三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池制造和液晶显示器制造中得到广泛应用.NF3是一种三角锥型分子,键角102°,沸点﹣129℃;可在铜的催化作用下由F2和过量NH3反应得到.
(1)写出制备 NF3的化学反应方程式: .
(2)NF3的沸点比NH3的沸点(﹣33℃)低得多的主要原因是 .
(3)NF3中N元素采取 方式杂化.
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,则该物质的化学式为 其中心离子是,配位数为 .
(5)已知氧族元素(氧O、硫S、硒Se、碲Te),工业上可用Al2Te3来制备H2Te,完成下列化学方程式:
Al2Te3+ ═ Al(OH)3↓+ H2Te↑
(6)已知在常温下,生成17g H2S放出56.1KJ的热量,试写出硫化氢分解的热化学方程式 .
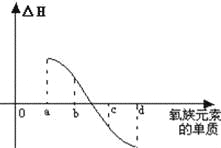
(7)如图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族中某一元素的单质,△H为相同物质的量的单质与H2反应的反应热.则:b代表 ,d代表 (均写单质名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是________________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32- + CH3COOH = CH3COO- + CO2 ↑ + H2O
B.ClO- + CH3COOH = CH3COO- + HClO
C.CO32- + HClO = CO2 ↑ + H2O + ClO-
D.2 ClO- + CO2 + H2O = CO32-+ 2 HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是__________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
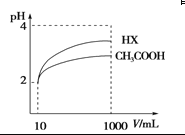
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化 如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.NH4Fe(SO4)2加入过量NaOH溶液中:NH4++Fe3++4OH-=NH3![]() H2O+Fe(OH)3↓
H2O+Fe(OH)3↓
B.次氯酸钠溶液中通入过量的二氧化硫:ClO-+SO2+H2O=HSO3-+HClO
C.Ba(OH)2溶液和稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气根据成分不同分为贫气和富气,贫气中甲烷的含量较多,富气中乙烷、丙烷、丁烷的含量相对高一些。若要将它们液化,下列说法正确的是
A.贫气易液化 B.富气易液化
C.二者液化条件相同 D.减压降温均有利于两者液化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料和新型燃料。
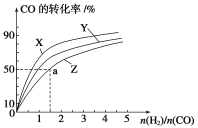
(1)工业上一般以CO和H2为原料在密闭容器中合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。下图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是________;该温度下上述反应的化学平衡常数为________;
CH3OH(g) ΔH=-90.8 kJ·mol-1。在容积为1 L的恒容容器中,分别研究在230 ℃、250 ℃和270 ℃三种温度下合成甲醇的规律。下图是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系,则曲线Z对应的温度是________;该温度下上述反应的化学平衡常数为________;
(2)下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

I.甲中负极的电极反应式为_________ _______
II.乙中反应的化学方程式为______ __ ________;A极析出的气体在标准状况下的体积为________________。
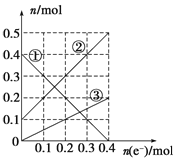
III.丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如下图,则图中②线表示的是________的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要________ mL 5.0 mol·L-1 NaOH溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学平衡常数的说法中,正确的是
A.在任何条件下,化学平衡常数都是一个定值
B.化学平衡常数K可以推断一个可逆反应进行的程度
C.化学平衡常数K只与温度、反应物浓度、体系的压强有关
D.当改变反应物的浓度时,化学平衡常数会发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com