
����Ŀ��A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�ء���֪��A��Dͬ���壬AԪ�ص�ԭ�Ӱ뾶�����ڱ�����С��BԪ����������������֮��Ϊ2��C��EԪ��ԭ�ӵ������������������ڲ��������3�����ش��������⣺
��1��E��Ԫ�����ڱ��е�λ��Ϊ_________��B���ʵĵ���ʽΪ_________����Ԫ�ط��ű�ʾ����
��2��Ԫ��A��C���γ�A2C2�ͻ�����û������д��ڵĻ�ѧ��Ϊ_________������ĸ����
a���������Ӽ�b�����й��ۼ�c���������Ӽ����й��ۼ�
��3��������M��N����A��C��D��E����Ԫ�ع��ɣ���������Һ�����Ӧ�����ӷ���ʽ��_________����4��B����̬�⻯�K������ˮ��ԭ����_________��
���𰸡���3������A�� ![]() b H++HSO3��=H2O+SO2�� NH3��H2O����֮���ܹ��γ����
b H++HSO3��=H2O+SO2�� NH3��H2O����֮���ܹ��γ����
��������
AԪ�ص�ԭ�Ӱ뾶�����ڱ�����С��A��HԪ�أ�A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�أ�A��Dͬ���壬D��NaԪ�أ�BԪ����������������֮��Ϊ2��B��NԪ�أ�C��EԪ��ԭ�ӵ������������������ڲ��������3����C��OԪ�ء�E��SԪ�ء�
��1��E��SԪ�أ���Ԫ�����ڱ��е�λ��Ϊ��3������A�壻B��NԪ�أ��䵥��N2�ĵ���ʽΪ![]() ��
��
��2��Ԫ��H��O�γ�A2C2�ͻ�������H2O2���û�����Ľṹ��H-O-O-H�����ڵĻ�ѧ��Ϊ���ۼ���ѡb��
��3��������M��N����H��O��Na��S����Ԫ�ع��ɣ����Ƿֱ���NaHSO4��NaHSO3������Һ�����Ӧ�����ӷ���ʽ��H++HSO3��=H2O+SO2����
��4��NԪ�ص���̬�⻯����NH3��NH3��H2O����֮���ܹ��γ����������NH3��������ˮ��


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ����״��ͱ�����Ļ�ѧԭ����2C6H5CHO��KOH![]() C6H5CH2OH��C6H5COOK��C6H5COOK��HCl��C6H5COOH��KCl����֪����ȩ�ױ��������������״��ķе�Ϊ205.3 �棬����ˮ�����������ѣ���������۵�Ϊ121.7 �棬�е�Ϊ249 �棬����ˮ�����������ѣ����ѵķе�Ϊ34.8 �棬������ˮ���Ʊ����״��ͱ��������Ҫ����������ʾ��
C6H5CH2OH��C6H5COOK��C6H5COOK��HCl��C6H5COOH��KCl����֪����ȩ�ױ��������������״��ķе�Ϊ205.3 �棬����ˮ�����������ѣ���������۵�Ϊ121.7 �棬�е�Ϊ249 �棬����ˮ�����������ѣ����ѵķе�Ϊ34.8 �棬������ˮ���Ʊ����״��ͱ��������Ҫ����������ʾ��
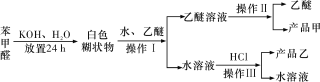
����������Ϣ�жϣ�����˵���������
A. ����������ȡ��Һ
B. ����������õ��IJ�Ʒ���DZ��״�
C. ��������˵õ��IJ�Ʒ���DZ������
D. ������Һ�����ܽ����Ҫ�ɷ��DZ��״�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
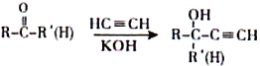
����Ŀ������������л��ϳ��е�һ����Ҫ�м��壬����ϳɹ������£����ֲ��P������ȥ����

��
��
��![]()
�ܻ�����A��һ�ȴ���ֻ��һ��
��1��G�����к��еĹ���������Ϊ___________��
��2��A��B�ķ�Ӧ����Ϊ________��G��H�ķ�Ӧ����Ϊ______��
��3��D�Ļ�ѧ����Ϊ_________��
��4��C�Ľṹ��ʽΪ______��L�Ľṹ��ʽΪ____��
��5��G��J�й��̢ٵĻ�ѧ����ʽΪ_______��
��6��ͬʱ��������������I��ͬ���칹����____�֣������������칹��������I�������������ͬ�Ĺ����Ţھ�����Ԫ̼���ṹ�۷�������һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п��������أ�ԭ����ͼ�������������е綯���Ķ�����Դ���õ�طŵ�ʱZnת��ΪZnO���õ�ع���ʱ������˵����ȷ����
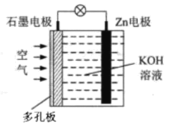
A.Zn�缫�Ǹõ�ص�����
B.Zn�缫�ĵ缫��Ӧ��Zn+H2O��2e=ZnO+2H+
C.OH��ʯī�缫�ƶ�
D.��״���£�������11.2LO2ʱ����·������2mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ��װ�ã��г����������ʡ�ԣ�����ʵ�飬��A��Ũ������μ���B�У�����ľ̿�����ش��������⣺

��1��ͼ��Cװ����ʵ���е�������____________��
��2��ľ̿��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ____________��
��3������������ͨ��D�У������й�ʵ������������ȷ����____________��
A����D�з���������BaCl2��Һ�����Բ������ְ�ɫ����
B����D�з���������Ca(OH)2��Һ�����Բ������ְ�ɫ����
C����D�з���������KMnO4��Һ��һ��ʱ�����Һ��ɫ����֤��ľ̿��Ũ���ᷴӦ����Ư������������
D����D�з���������ɫʯ����Һ��һ��ʱ�����Һ�ȱ��ɫ����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǵ�3����11~17��Ԫ��ijЩ���ʱ仯���Ƶ�����ͼ�������й�˵������ȷ����( )

A. y���ʾ�Ŀ����ǵ�һ������
B. y���ʾ�Ŀ����ǵ縺��
C. y���ʾ�Ŀ�����ԭ�Ӱ뾶
D. y���ʾ�Ŀ�����ԭ���γɼ�����ת�Ƶĵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���ش��й����⣺
���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1�����л�ѧ��������õ�Ԫ����______������Ԫ�ط��ű�ʾ��
��2���ڢۢ�����Ԫ�ص�ԭ�Ӱ뾶�Ӵ�С��˳����______����Ԫ�ط��ű�ʾ��
��3���õ���ʽ��ʾ������γɻ�����Ĺ���_______________________��
��4���ڢ١���Ԫ���У�Ԫ�ص�����������Ӧ��ˮ�����м�����ǿ��___�����ѧʽ��
��5���ڢ����ĵ����У���ѧ���ʽϻ��õ���_____�����ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֽ�����ɵĺϽ�65g����ȫ��Ӧ����������71g����Ͻ�Ŀ����ǣ� ��
A.Cu��ZnB.Na��HgC.Fe��CuD.Cu��Ca
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܶ�Ϊ1.18g/ml����������Ϊ36.5%Ũ��������250ml0.1mol/L��������Һ����ղ���ش��������⣺
��1������250ml0.1mol/L��������Һ��Ӧ��ȡ�������_________ml��Ӧѡ������ƿ�Ĺ��__________________ml��
��2������ʱ������ȷ�IJ���˳����________��
A����30mlˮϴ���ձ� 2��3�Σ�ϴ��Һ��ע������ƿ����
B������Ͳ��ȷ��ȡ�����Ũ�����������ز����������ձ��У��ټ�������ˮ��Լ30ml�����ò���������������ʹ���Ͼ���
C��������ȴ�������ز�����ע��250ml������ƿ��
D��������ƿ�ǽ�����ҡ��
E�����ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
F������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
a��BCAFED b��BCFED c��BCAED
��3������B�У�ʹ����Ͳ��ȡҺ��ʱ���߸��ӻ��������Һ��Ũ��__________��ƫ�ߡ�ƫ�ͻ���Ӱ�죩������E�м�ˮ�����̶��߸���δ�����____________
��4�������������������������ҺŨ�Ƚ��к�Ӱ�죨ƫ�ߡ�ƫ�ͻ���Ӱ�죩��
a��û�н���A����____________��
b��������ˮʱ���������˿̶�___________��
c������ʱ����_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com