
����Ŀ��ij��ȤС���Է���м�Ƶ���������狀����������Ʊ���ˮ�ϲ�������(![]() )����һ���Ʊ��ߴ��Ȼ�ԭ���ۡ�
)����һ���Ʊ��ߴ��Ȼ�ԭ���ۡ�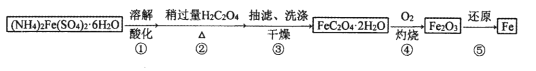
��֪��![]() ������ˮ��
������ˮ��![]() �Ƕ�Ԫ���ᣬ����ˮ��
�Ƕ�Ԫ���ᣬ����ˮ��
(1)�������H2C2O4�Թ�����Ŀ���ǣ�_____________________��
(2)������еõ�FeC2O4.2H2O�����ӷ�Ӧ����ʽΪ��_________________________��
(3)ʵ�ֲ���ܣ������� ______(����������)�н��У��ò��跢���Ļ�ѧ��Ӧ����ʽΪ��______________
(4)Ϊʵ�ֲ���ݣ�������̼��ֱ�ӻ�ԭFe2O3��������________________________��
(5)��������![]() ����һ���ɳƳ������������ڼ��ȣ�
����һ���ɳƳ������������ڼ��ȣ�![]() ( Mr=180)������ʧȥ�ᾧˮ���¶ȼ�������ʱ.
( Mr=180)������ʧȥ�ᾧˮ���¶ȼ�������ʱ.![]() (Mr=144)����ת��Ϊ���ĸ����������ȡ18.00g
(Mr=144)����ת��Ϊ���ĸ����������ȡ18.00g![]() ���������ȣ�ʣ�������������¶ȱ仯�IJ����������±�(����450����ǰ�Ǹ����������ȣ�450���Ժ����ڿ����м���)��
���������ȣ�ʣ�������������¶ȱ仯�IJ����������±�(����450����ǰ�Ǹ����������ȣ�450���Ժ����ڿ����м���)��
�¶�/�� | 25 | 150 | 300 | 350 | 400 | 450 | 500 | 600 | 700 | 800 |
��������/g | 18.00 | 16.20 | 14.40 | 14.40 | 7.20 | 7.20 | 8.00 | 8.00 | 7.73 | 7.73 |
�����������ݼ��㲢�ƶϣ�150��ʣ��Ĺ���������________________(�ѧʽ����ͬ)��800��ʣ��Ĺ���������________________��
���𰸡�ʹ![]() ������ȫ���Ӷ���߲��� Fe2++H2C2O4+2H2O=FeC2O4
������ȫ���Ӷ���߲��� Fe2++H2C2O4+2H2O=FeC2O4![]() 2H2O+2H+ ��� 4FeC2O4
2H2O+2H+ ��� 4FeC2O4![]() 2H2O+3O2
2H2O+3O2![]() 2Fe2O3+8CO2+8H2O �Ӵ����С����Ӧ����ȫ�����������л��������̼�� FeC2O4
2Fe2O3+8CO2+8H2O �Ӵ����С����Ӧ����ȫ�����������л��������̼�� FeC2O4![]() 2H2O Fe2O3
2H2O Fe2O3
��������
��������茶����ܽ���ˮ����������IJ��ᣬ���ɵIJ����������壨FeC2O4![]() 2H2O��������ˮ����ͨ�����ˡ�ϴ�Ӳ������ã������þ����ڿ��������գ��ô���������Fe2O3��������CO��ԭ�������õ���ԭ���ۣ��Դ˷������
2H2O��������ˮ����ͨ�����ˡ�ϴ�Ӳ������ã������þ����ڿ��������գ��ô���������Fe2O3��������CO��ԭ�������õ���ԭ���ۣ��Դ˷������
(1) �����H2C2O4�Թ���������Ҫ�������ǽ���Һ���Fe2+��ȫת��Ϊ�����������壬���ԭ�������ʣ�
�ʴ�Ϊ��ʹ![]() ������ȫ���Ӷ���߲��ʣ�
������ȫ���Ӷ���߲��ʣ�
(2)������еõ�FeC2O4![]() 2H2O�����ӷ�Ӧ����ʽΪ��Fe2++H2C2O4+2H2O=FeC2O4
2H2O�����ӷ�Ӧ����ʽΪ��Fe2++H2C2O4+2H2O=FeC2O4![]() 2H2O+2H+��
2H2O+2H+��
�ʴ�Ϊ��Fe2++H2C2O4+2H2O=FeC2O4![]() 2H2O+2H+��
2H2O+2H+��
(3) ����������Ҫ�������ڽ��У�����������O2����ʱ������Ӧ�Ļ�ѧ����ʽΪ4FeC2O4![]() 2H2O+3O2
2H2O+3O2![]() 2Fe2O3+8CO2+8H2O��
2Fe2O3+8CO2+8H2O��
�ʴ�Ϊ��������4FeC2O4![]() 2H2O+3O2
2H2O+3O2![]() 2Fe2O3+8CO2+8H2O��
2Fe2O3+8CO2+8H2O��
(4) �����ѡ��̼�ۻ�ԭFe2O3��Ϊ�����ķ�Ӧ���Ӵ����С����Ӧ����ȫ�������̼�ۻ�Ӱ�����۵Ĵ��ȣ�
�ʴ�Ϊ���Ӵ����С����Ӧ����ȫ�����������л��������̼�ۣ�
(5)���������Ϣ��450����ǰ�Ǹ����������ȣ��������е����ݿ�֪��18.00g��Ϊ14.40g ʱ��������300��ʱ���ᾧˮ��ȫ��ʧȥ����150��ʣ��Ĺ�����������Ϊ14.40g <16.20g<18.00g��˵��FeC2O4![]() 2H2Oû�зֽ���ȫ������FeC2O4
2H2Oû�зֽ���ȫ������FeC2O4![]() 2H2Oʣ�ࣻ
2H2Oʣ�ࣻ
450���Ժ����ڿ����м��ȣ�����Ԫ���غ㣺6FeO��2Fe3O4��3Fe2O3
6��72��2��232��3��160=72��77.3��80
��72��77.3��80��7.20��7.73��8.00�����������ı仯����������ṩ������һ�£���800��ʣ��Ĺ�������Ϊ��Fe2O3��
�ʴ�Ϊ��FeC2O4![]() 2H2O��Fe2O3��
2H2O��Fe2O3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ�ɻ��������Դ��������CH3OCH3)������˵������ȷ����
��C(s) + H2O(g)==CO(g)+H2(g) ��H1=a kJmol-1
��CO(g) + H2O(g)==CO2(g)+H2(g) ��H2=b kJmol-1
��CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ��H3 =c kJmol-1
��2CH3OH(g) ==CH3OCH3(g)+H2O(g) ��H4=d kJmol-1
A. ��Ӧ�٢�Ϊ��Ӧ���ṩԭ����
B. ��Ӧ��Ҳ��CO2��Դ�����õķ���֮һ
C. ��ӦCH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)����H =
H2O(1)����H =![]() kJmol-1
kJmol-1
D. ��Ӧ 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)����H= (2b+2c+d) kJmol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������з�����Ӧ��aX(g)+bY(g)![]() cZ(g)+dW(g)��Ӧ�ﵽƽ����������ѹ����
cZ(g)+dW(g)��Ӧ�ﵽƽ����������ѹ����
ԭ����һ�룬���ٴδﵽƽ��ʱ��W��Ũ��Ϊԭƽ��״̬��1.8��������������ȷ����
A. ƽ��������Ӧ�����ƶ� B. (a+b)>(c+d)
C. Z������������ D. X��ת���ʱ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() Ϊ�����ӵ�������ֵ������˵���������
Ϊ�����ӵ�������ֵ������˵���������
A. 0.1mol![]() ��0.1mol
��0.1mol![]() ���ܱ������г�ַ�Ӧ����Ӧ���������Ϊ0.2
���ܱ������г�ַ�Ӧ����Ӧ���������Ϊ0.2![]()
B. �����������ͨ�������Ķ�����̼������������28g��ת�Ƶ�����Ϊl![]()
C. �ڱ�״���£�22.4LHF��![]() ��
��![]() �к��еĵ�������ͬ
�к��еĵ�������ͬ
D. ����![]() ��
��![]() �������������������У���Ԫ�ص���������56g
�������������������У���Ԫ�ص���������56g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��LEDϵ�в�Ʒ��һ�����ͽ��ܲ�Ʒ��ͼ����![]() /
/![]() ȼ�ϵ�أ�ͼ����LED��������ܵ�װ��ʾ��ͼ�����������������
ȼ�ϵ�أ�ͼ����LED��������ܵ�װ��ʾ��ͼ�����������������

A. ����ܷ�ӦΪ��![]()
B. ��طŵ�����У�![]() ��B������A�����ƶ�
��B������A�����ƶ�
C. ��طŵ�����У�B����pH��С��A����pH����
D. ҪʹLED����������������⣬ͼ���еĵ���aӦ��ͼ���е�A������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��ȷ���ǣ� ��
A.NaOH���뷽��ʽ��NaOH=Na����H����O2��
B.�������ĵ��뷽��ʽ��Al2(SO4)3=Al23����(SO4)32��
C.NaCl�ĵ��뷽��ʽ��NaCl![]() Na����Cl��
Na����Cl��
D.������淋��뷽��ʽ��NH4HSO4 =NH4+��H+��SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�������������ԭ��Ӧ����(����)
A.H2+Cl2![]() 2HClB.Cl2 + H2O= HCl + HClO
2HClB.Cl2 + H2O= HCl + HClO
C.NH4HCO3![]() NH3��+CO2��+H2OD.Zn+H2SO4=H2��+ZnSO4
NH3��+CO2��+H2OD.Zn+H2SO4=H2��+ZnSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�����ʵ����ʵ���Ũ��Ϊ1mol/L���ǣ� ��
A. ��58.5g NaCl�ܽ���1Lˮ��
B. ��1L 10mol/L���������9Lˮ��
C. ��11.2L HCl��������ˮ���0.5L��Һ
D. ��40g NaOH�ܽ�������ˮ�У��ټ�����ˮֱ����Һ���Ϊ1L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������500 mL 0.2 mol/L��Na2SO4��Һ��ʵ����������У�
A������ƽ�ϳƳ�14.2 g�����ƹ��壬���������ձ��У�������������ˮʹ����ȫ�ܽⲢ��ȴ�����¡�
B�����Ƶõ���ҺС�ĵ�ת�Ƶ�����ƿ�С�
C������������ƿ�м�����ˮ��Һ���̶���1��2 cm�������ý�ͷ�ι�С�ĵμ�����ˮ����Һ��Һ����ʹ���̶������С�
D������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ע������ƿ����������
E��������ƿƿ�����������ҡ�ȡ�
����д���пհף�
(1)�����������ȷ˳��Ϊ(�����)________��
(2)��ʵ���õ��Ļ������������ձ�����ƽ(�����롢����)������������ȱ�ٵ������� _______��_______�� _______��
(3)���������ʹ������ҺŨ��ƫ�ߵ���(�����)______��
a��û���������IJ�������D
b��������ˮʱ�����������˿̶���
c��������մ������
d������ƿʹ��ǰ�ڱ�մ��ˮ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com