
����Ŀ����Ȼ���е����ʾ�������Ի�������ʽ���ڣ�Ϊ�˱����о������ã�����Ի������з�����ᴿ������A��B��C��D����ѧ�����Ļ���������ᴿ��װ�á�
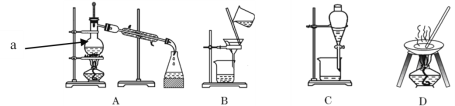
I������ݻ���������ᴿ��ԭ�����ش�������ʵ������Ҫʹ������װ�á���A��B��C��D �����ʵ��Ŀո��С�
��1��̼�������Һ�з����̼���___________��
��2���Ȼ�����Һ�з�����Ȼ���___________��
��3������ֲ���ͺ�ˮ___________��
��4����ˮ����___________��
��5���Ȼ�����Һ�з����ˮ___________��
��6����ȥ����ˮ�е�Cl��������___________��
��7���ӵ�ˮ�з����I2___________��
II����ˮ����ȡ�ⵥ�ʵķ������£�
��1����ȡ��Һ
�����п���Ϊ��ˮ����ȡ�ⵥ����ȡ������___________
A���ƾ� B����
�ڷ�Һ©����ʹ��ǰ������___________
�۲����ϵ�֪���ѣ�H2O��>��������>�����ƾ��������â�����ѡ��ȡ����ȡ��ˮ�еĵⵥ�ʣ���Һʱ��ˮ��Ӧ�ɷ�Һ©����______�˿ڷų����л���Ӧ�ɷ�Һ©����______�˿ڷų���������������������������
��2������
��װ��A��a��������_______������װ��������ˮӦ��________�ڽ�����������������������
��������Ŀ����________________________��װ��C�ڷ�ҺʱΪʹҺ��˳�����£�����©���¶˵������⣬��Ӧ���еľ��������__________________________��
����֪������Ȼ�̼���۷е��������±�
�۵� | �е� | |
�� | 113.7�� | 184.3�� |
���Ȼ�̼ | -22.6�� | 76.8�� |
���������������Ȼ�̼�Ļ�����ƿ�����ռ��������ʵ�������___________��
��. ��ˮ���̲��ŷḻ����Դ����ʵ������ȡ������ˮ�������������̵�ʵ�飺
[��ˮ]![]() [����]
[����]![]() [ʳ��ˮ]��[�Ȼ��ƾ���]
[ʳ��ˮ]��[�Ȼ��ƾ���]
����һ�������к�Ca2+��Mg2+��SO42�������ʣ���Ҫ�ᴿ������ۺ������������ᴿ�IJ����У�
�����������Na2CO3��Һ�������������BaCl2��Һ�������������NaOH��Һ����������Һ��pH����7�����ܽ� �����ˡ���������ȷ�IJ���˳����__________����ѡ����ĸ��.
a.�ݢڢۢ٢ޢܢ� b���ݢ٢ڢۢޢܢ� c���ݢڢ٢ۢܢޢ� d���ݢۢڢ٢ޢܢ�
��������ɺ�ˮ���Ȼ��ƾ����ʵ�������Ҫ�õ�����Ҫװ����_________________���Ӹ���������װ����ѡ������ĸ����
�������������к���������ɳ��CaCl2��MgCl2�������Σ��������ܽ���ȹ��˽���ɳ��ȥ���ټ�����Һ�е�SO42����������Һ�е�SO42����ʵ�������������______________________________��
���𰸡�BDCAAACB����Ƿ�©Һ����������ƿ��ʹˮ���������ܣ�ˮ�����������������෴������Ч�����ý���Һ©�����ϵIJ�������ʹ���ϵİ��۶�©���ϵ�С�����Ȼ�̼adBDȡ������Һ���Թ��У��μ����������ữ��BaCl2��Һ�����а�ɫ����������˵������SO42����
��������
I����1��̼�������Һ�з����̼��ƣ�̼��Ʋ�����ˮ������ͨ�����˲������룬��Ӧ��ѡ��װ��B���ʴ�Ϊ��B��
��2���Ȼ�����Һ�з�����Ȼ��ƣ���Ҫͨ������������ɣ�Ӧ��ѡ��װ��D���ʴ�Ϊ��D��
��3������ֲ���ͺ�ˮ�����������ܣ�����ͨ����Һ������ɣ�Ӧ��ѡ��װ��C���ʴ�Ϊ��C��
��4����ˮ��������Ҫͨ�����������ȥˮ�е��Ȼ��Ƶ��ѻӷ������ʣ�ѡ�õ�װ��ΪA���ʴ�Ϊ��A��
��5���Ȼ�����Һ�з����ˮ���Ȼ��Ʒе�ϸߣ�����ͨ�����������ɣ�����Ӧ��ѡ��װ��A���ʴ�Ϊ��A��
��6����ȥ����ˮ�е�Cl�������ʣ����ʵķе�ϸߣ�����ͨ�����������ɣ�����Ӧ��ѡ��װ��A���ʴ�Ϊ��A��
��7���ӵ�ˮ�з����I2����Ҫͨ����ȡ������Ȼ��ͨ����Һ������ɣ�Ӧ��ѡ��װ��C���ʴ�Ϊ��C��
II����1������ˮ����ȡ�ⵥ�ʣ���Ҫͨ����ȡ������ѡȡ����ȡ��������ˮ���ܣ����Բ���ѡ��A�ƾ�������ѡ�ñ����ʴ�Ϊ��B��
����Һ©����ƿ��������������Һ©��ǰ�������Һ©���Ƿ�©Һ���ʴ�Ϊ������Ƿ�©Һ��
�������ѣ�H2O�����������������ñ�Ϊ��ȡ����ȡ��ˮ�еĵⵥ�ʣ��л������Ϸ���ˮ�����²㣬���Һʱ��ˮ��Ӧ�ɷ�Һ©�����϶˿ڷų����л���Ӧ�ɷ�Һ©�����¶˿ڷų����ʴ�Ϊ���£��ϣ�
��2����װ��A��a����Ϊ������ƿ����������ͨˮʱ��ͨ����������ͨˮ�������������ܵ��¿ڽ�ˮ������Ч������ã�װ��C�ڷ�ҺʱΪʹҺ��˳�����£�����©���¶˵������⣬����Ҫ����Һ©�����ϵIJ�������ʹ���ϵİ��۶�©���ϵ�С�����ʴ�Ϊ��������ƿ���£�ʹˮ���������ܣ�ˮ�����������������෴������Ч������������Һ©�����ϵIJ�������ʹ���ϵİ��۶�©���ϵ�С����
�����ݱ��еⵥ�ʺ����Ȼ�̼�ķе��֪�����Ȼ�̼�ķе�ϵͣ������Ȼ�̼���ȱ���������ƿ�����ռ���������Ϊ���Ȼ�̼���ʴ�Ϊ�����Ȼ�̼��
��. ����һ����ȥ�����еĿ��������ʣ�Mg2+��Ca2+��Fe3+��SO42-ʱ�����Լ������NaOH��ȥ��þ���Ӻ������ӣ���Mg2++2OH-=Mg��OH��2����Fe3++3OH-�TFe��OH��3�����������BaCl2��ȥ����������ӣ���SO42-+Ba2+=BaSO4�����������Na2CO3��ȥ�������ӺͶ���ı����ӣ���Ca2++CO32-=CaCO3��̼���Ʊ�������Ȼ���֮���������ƺ��Ȼ������Եߵ������˳��Ȼ�������Һ��pH����7���������ɣ��������˳��Ϊ�ݢڢۢ٢ޢܢ����ݢۢڢ٢ޢܢ����ʴ�Ϊ��ad��
��������ɺ�ˮ���Ȼ��ƾ����ʵ�������Ҫ�õ������ķ�����Ϊ��ȥ���ʣ�Ӧ���ˣ���Ҫװ����BD���ʴ�Ϊ��BD��
��������SO42-�뱵���ӷ�Ӧ���ɲ�����ǿ������ᱵ�������ݴ˿ɼ�����������ӣ����Լ�����Һ��SO42-��ʵ�����Ϊ��ȡ������Һ��С�Թ��У��μ����������ữ��BaCl2��Һ�����а�ɫ����������˵������SO42-���ʴ�Ϊ��ȡ������Һ��С�Թ��У��μ����������ữ��BaCl2��Һ�����а�ɫ����������˵������SO42-��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ʯ�͵��ѻ���ú��������Һ�������ڻ�ѧ�仯����ʯ�͵ķ�����ú�ĸ������������仯
B. ![]() ��ϵͳ������Ϊ2��5-����-4-�һ�����
��ϵͳ������Ϊ2��5-����-4-�һ�����
C. ������һ��ʱ������ͼ�ȩ�����Ժ��ֱ�����ϣ���ȫȼ�����������������
D. ��֬�����ۡ������ʵȸ߷��ӻ����ﶼ���ڻ���һ�������¾��ɷ���ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д����ͼ��������������������ƣ�

��___________����___________�� ��___________�� ��___________��
��2�������������У�ʹ��ʱ�������Ƿ�©ˮ����__________����������ţ���
��3����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص�Ũ�����Լ���ǩ�ϵIJ������ݡ����ø�Ũ��������480 mL 1 mol��L��l��ϡ���ᡣ

�ɹ�ѡ�õ������У� ����ͷ�ιܣ�����ƿ�����ձ�����ҩ�ף�����Ͳ����������ƽ��
��ش��������⣺
������ϡ����ʱ����ȱ�ٵ�������__________��__________��д�������ƣ���
�������㣬����480 mL l mol��L��l��ϡ������Ҫ����Ͳ��ȡ����Ũ��������Ϊ________mL������ȡ�õ�Ũ���Ỻ��ע�뵽ʢˮ���ձ�������Ͳ�ﻹ������Ũ���ᣬ���������ˮϴ�Ӻ�һ����ϴ��Һע���ձ�����ʹ���Ũ��______������ƫ������ƫ����������Ӱ��������
����ת������ƿǰ�ձ���Һ��Ӧ_______�������ʹ���Ũ��____������ƫ������ƫ����������Ӱ��������
������ʱ����ʹ��Һ�İ�Һ����̶�����ƽ�������ӻ�ʹŨ��______��������ƫ������ƫ����������Ӱ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ�Ͳ�Ʒ�г�����H2S�⣬�����и�����̬���л�����COS��CH3SH���ش���������:
��1��CH3SH(����)�ĵ���ʽΪ________��
��2��һ��������Ϊ:���K2CO3������˹����
��K2CO3��Һ����H2S�ķ�ӦΪK2CO3+H2S=KHS+KHCO3���÷�Ӧ��ƽ�ⳣ���Ķ���ֵΪlgK=_____(��֪:H2CO3 lgK1=-6.4��lgK2=-10.3��H2SlgK1=-7��lgK2=-19)��
����֪�����Ȼ�ѧ����ʽ:
a.2H2S(g)+3O2(g)=2SO2(g)+ 2H2O(l) ��H1=-1172kJ/mol
b.2H2S(g)+O2(g)=2S(s)+2H2O(l) ��H2=-632kJ/mol
����˹��������ķ�ӦΪSO2��H2S���巴Ӧ����S(s)����÷�Ӧ���Ȼ�ѧ����ʽΪ__________��
��3��Dalleska�����о�������ǿ����Һ�п���H2O2����COS�����ѳ���Ӧ�Ļ�ѧ����ʽΪ______________��
��4��COSˮ�ⷴӦΪCOS(g)+H2O(g)![]() CO2(g)+H2S(g) ��H=-35.5kJ/mol��
CO2(g)+H2S(g) ��H=-35.5kJ/mol��
�û�����-Al2O3����������������ͬʱ���ı䷴Ӧ�¶ȣ����COSˮ��ת������ͼ1��ʾ��ij�¶�ʱ���ں����ܱ�������Ͷ��0.3molH2O(g)��0.1molCOS��COS��ƽ��ת������ͼ2��ʾ��

��ͼ1������-Al2O3��ˮ�⣬���¶�����ת������������ּ�С�Ŀ���ԭ����________��
����ͼ2��֪��P��ʱƽ�ⳣ��ΪK=______(������)��
��������-Al2O3��ˮ�⣬Ϊ���COS��ת���ʿɲ�ȡ�Ĵ�ʩ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ʵ���ɫ��Ӧ�ʻ�ɫ�������ж���ȷ���ǣ� ��
A.������һ���ǽ�����B.������һ��������
C.������һ��������Ԫ��D.������һ�������м�Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�������ʵ�鷽�����Է���NaCl��BaCl2���ֹ�������ش��������⣺
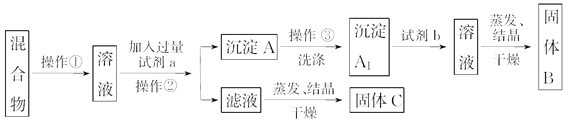
��ѡ�Լ���Na 2CO3��Һ��Na2SO4��Һ��K2CO3��Һ��K2SO4��Һ������
��1����������������______________��
��2���Լ�a��________(�ѧʽ����ͬ)���Լ�b��____________������B��________��
��3�������Լ�a�������Ļ�ѧ��Ӧ����ʽΪ_______________________________________��
��4������ϴ�ӵIJ�������____________________________________________________________��
��5���÷����ܷ�ﵽʵ��Ŀ��?___________�������ܣ�Ӧ��θĽ�(���ܣ����ʲ��ûش�)________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ�У�ʲô����Ӱ���˻�ѧ��Ӧ�����ʣ�
��1��ʳƷ����ù�䣬����Ͳ���������������
��2������طų����ݺ��������������������̺ܿ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУͬѧ��ʵ�����ж�һ����̼������Ʒ�Ӧ������̽�����ش�����������
��1������ͬѧ����CaSO4��2H2O��400--500����ˮ��ȡ��ˮCaSO4��ʵ�������õ��ļ���װ���еĹ������ʵ��������������⣬���õ�______________��
��2������ͬѧ����H2C2O4��2H2O��Ũ������������ˮ����CO��CO2���Ʊ�������CO���壬ʵ��װ��������

B��C��ʢ�ŵ��Լ�����Ϊ______��____________��
��3������ͬѧ���ü����Ƶõ���ˮCaSO4�������Ƶõ�CO����������װ����֤��Ӧ��������̬��������SO2��CO2������

������װ��(����װ�ÿ��ظ�ʹ��)������˳��ΪC��___________��
����E��Һ��ɫ��������Ӧ�����ӷ���ʽΪ_____________��
����֤����CO2�����ɵ�ʵ��������____________��
����G�в���ΪCaO����G�з�����Ӧ�Ļ�ѧ����ʽΪ_________________��
��4�������ͬѧȡ����ʵ���Gװ���еĹ����������Թ��У�Ȼ���������ϡ���ᣬ������ȫ��Һ�Ҳ����������壬ͨ��CuSO4��Һ�к�ɫ����������֤CO��CaSO4�ڸ����»�������һ������Ӧ���÷�ӦΪ______________(�÷���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 L�ܱ������У���1 mol A��1 mol B��Ϸ������·�Ӧ��3A(g)+B(g) ![]() xC(g)+2D(g)������Ӧ�ﵽƽ��ʱ������0.4 mol D�������C��ƽ��Ũ��Ϊ0.4 mol/L�����������в���ȷ���ǣ� ��
xC(g)+2D(g)������Ӧ�ﵽƽ��ʱ������0.4 mol D�������C��ƽ��Ũ��Ϊ0.4 mol/L�����������в���ȷ���ǣ� ��
A. x��ֵΪ2 B. A��ת����Ϊ60%
C. B��ƽ��Ũ��Ϊ0.8 mol/L D. D���������Ϊ25%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com