
 已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).
已知在电解槽中,每小时通过1A的直流电理论上可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8h,制得32%的烧碱溶液(密度为1.342t/m3)113m3,电解槽的电流强度1.45×104A,该电解槽的电解效率为93.46%(保留两位小数).  阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 将煤通过物理变化液化后再作为能源,可减少PM2.5引起的危害 | |
| B. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 | |
| C. | 普通玻璃属于无机非金属材料,有机玻璃属于新型无机非金属材料 | |
| D. | 氟氯烃是安全、环保的制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
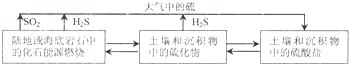
| 25℃ | 饱和H2S溶液 | FeS | SnS | |
| pH | 3.9 | 3.0(开始沉淀 | 5.5(沉淀完全) | 1.6(沉淀完全) |
| Ksp | 6.3×10-18 | 1.0×10-25 | ||
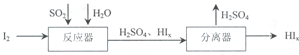
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
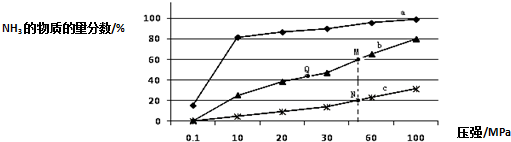
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液显弱酸性 | |
| B. | 该溶液中K+、Al3+、H+、SO${\;}_{4}^{2-}$可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1 mol/L Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存 | |
| B. | 常温下,$\frac{{K}_{W}}{c({H}^{+})}$=0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3- | |
| C. | 清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)?SO42-(aq)+CaCO3(s) | |
| D. | 向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-═BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
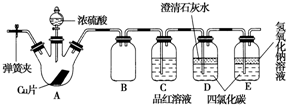
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 | |
| B. | 废旧电池不能随意丢弃,要进行深埋处理,防止重金属污染 | |
| C. | “冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 | |
| D. | 人类日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
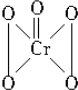
| A. | 全部-1价 | B. | $\frac{4}{5}$为-1价,$\frac{1}{5}$为-2价 | ||
| C. | 全部-2价 | D. | $\frac{4}{5}$为-2价,$\frac{1}{5}$为-1价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com