
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
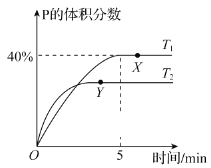
A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
【答案】A
【解析】
A. 若X点P的体积分数40%,Y点P的体积分数小于40%,X点P的含量高,P为生成物,产率越大,平衡常数越大,两点的平衡常数分别为K1、K2,则K1>K2,故A正确;
B. 温度为T1时,设N的变化量为xmol,根据反应:
M(s)+2N(g)![]() P(g)+Q(g)
P(g)+Q(g)
初始(mol):1 2 0 0
变化(mol): x ![]()
![]()
平衡(mol): 2-x ![]()
![]()
温度为T1时,X点P的体积分数=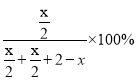 =40%,解得x=1.6mol。
=40%,解得x=1.6mol。
N的平衡转化率为=![]() =80%,平衡常数K=
=80%,平衡常数K=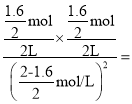 4,故B错误;
4,故B错误;
C. 该反应为反应前后气体体积不变的体系,压强不影响平衡移动,不能做为达到平衡的判断依据,故C错误;
D.该反应为反应前后气体体积不变的体系,增大压强,反应速率加快,但压强不影响平衡移动,转化率不变;根据“先拐先平数值大”的原则,T2> T1,降低温度P的体积分数减少,反应向逆向进行,即放热的方向进行,反应物的转化率较低,故D错误;
答案选A。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入100mL 1mol/L 的盐酸,恰好使混合物完全反应,放出 11.2mL(标准状况)气体,所得溶液加入 KSCN 溶液不变红色。用足量的CO 在高温下还原相同质量的此混合物,所得铁的质量为
A. 2.8g B. 11.2g C. 5.6g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室模拟工业生产漂白粉的装置(夹持和加热装置省略)。
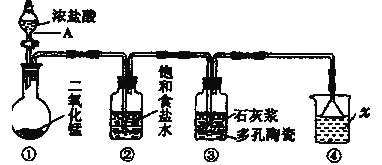
(1)写出图中仪器A的名称___;②装置中饱和食盐水的作用是___。
(2)装置①中发生反应的化学方程式为___。
(3)装置③中发生反应的化学方程式为___。
(4)装置④中发生反应的离子化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油化工产品1,3-丁二烯合成化工中间物 ![]() 的合成路线如下:
的合成路线如下:
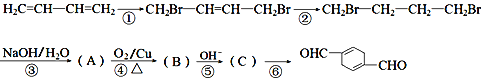
已知:![]() 。
。
(1)A的系统命名为____________________。
(2)![]() 含有的官能团为______________________________。
含有的官能团为______________________________。
(3)写出③⑥的反应类型分别为__________、__________。
(4)反应④的化学方程式为_____________________________________________。
(5)![]() 的同分异构体中,满足以下条件的有__________种,其中核磁共振氢谱显示有5组峰的结构简式为____________________。
的同分异构体中,满足以下条件的有__________种,其中核磁共振氢谱显示有5组峰的结构简式为____________________。
①能与FeCl3溶液发生显色反应;②能发生银镜反应。
(6)请设计合理方案用![]() 合成
合成![]() (其他原料自选,用反应流程图表示,并注明必要的反应条件)____________________。
(其他原料自选,用反应流程图表示,并注明必要的反应条件)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)俗称“工业盐”,其外观与食盐相似,有咸味,有毒,可用做食品防腐剂和肉类食品的发色剂。已知亚硝酸钠能与氢碘酸(HI,具有强酸性)发生如下反应:4HI+2NaNO2=2NaI+I2+2NO↑+2H2O。下列说法正确的是
A. 亚硝酸钠具有氧化性,不可能表现出还原性
B. 该反应中氧化剂与还原剂的物质的量之比为1:1
C. 向反应所得的混合溶液中加入稀硫酸和亚硝酸钠,I-不可能转化为I2
D. 人误食亚硝酸钠中毒时,可服用氢碘酸解毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
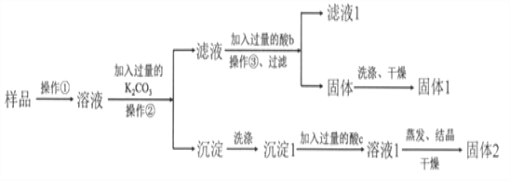
(1)试剂c的化学式是__________,固体1的化学式是__________。加入过量K2CO3所发生反应的化学方程式为________________________________。
(2)结合下图各物质的溶解度曲线可知操作③的名称是_______、________。
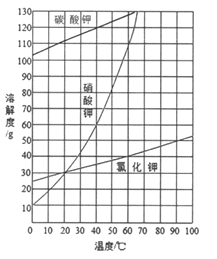
(3)有同学认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该同学的观点是否正确?_____;并做出相应解释___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式不正确的是
A. FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B. 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br+2Cl2=2Fe3++Br2+4Cl
C. 向明矾溶液中滴加Ba(OH)2,恰好使![]() 沉淀完全:2Al3++3
沉淀完全:2Al3++3![]() +3Ba2++6OH=2A1(OH)3↓+3BaSO4↓
+3Ba2++6OH=2A1(OH)3↓+3BaSO4↓
D. 向碳酸钠溶液中滴加过量的稀硫酸:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),下列说法错误的是 ( )
CuS(s)+Mn2+(aq),下列说法错误的是 ( )
A. 相同条件下,MnS的Ksp比CuS的Ksp大
B. 该反应的平衡常数K=![]()
C. 该反应达到平衡时c(Mn2+)=c(Cu2+)
D. 往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com