

分析 (1)NH4Cl与Ca(OH)2加热时发生反应生成氯化钙、氨气和水;
(2)氨气极易溶于水,比空气轻,用向下排空气方法收集,导气管短进长出,吸收尾气需要防止倒吸;
(3)将装置C替换为图4,从d中同时通入纯净干燥的氯气,氯气和氨气发生氧化还原反应生成白色烟氯化铵固体颗粒,氯气黄绿色褪去,利用铵根和强碱反应生成氨气能使湿润的红色石蕊试纸变蓝设计实验检验;
(4)一水合氨是弱电解质存在电离平衡,可以利用稀释10倍测定溶液PH变化设计,也可以取PH相同的一水合氨溶液和氢氧化钠溶液稀释相同倍数来测定PH设计实验验证.
解答 解:(1)图1装置中加入NH4Cl与Ca(OH)2,加热时发生反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气极易溶于水,比空气轻,用向下排空气方法收集,导气管短进长出,装置内导管正确的连接方式为: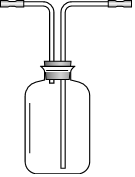 ,吸收尾气需要防止倒吸,装置a直接插入水中会引起倒吸,装置b中四氯化碳不溶于水,氨气不溶于四氯化碳上冒时被上层水吸收可以防止倒吸,装置c倒扣在水面的漏斗可以防止倒吸,
,吸收尾气需要防止倒吸,装置a直接插入水中会引起倒吸,装置b中四氯化碳不溶于水,氨气不溶于四氯化碳上冒时被上层水吸收可以防止倒吸,装置c倒扣在水面的漏斗可以防止倒吸,
故答案为: ;bc;
;bc;
(3)将装置C替换为图4,从d中同时通入纯净干燥的氯气,氯气和氨气发生氧化还原反应生成白色烟氯化铵固体颗粒,8NH3+3Cl2=6NH4Cl+N2.氯气黄绿色褪去,检验产物NH4Cl中NH4+的方法是取样溶于水,加入氢氧化钠浓溶液并加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝,证明含有NH4+,
故答案为:黄绿色褪去,有白烟生成;取样溶于水,加入氢氧化钠浓溶液并加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝,证明含有NH4+,
(4)一水合氨是弱电解质存在电离平衡,电离方程式为:NH3•H2O?NH4++OH-,设计实验证明:稀释氨水时上述电离平衡会发生移动,可以设计为:方案一:取相同pH的氨水与NaOH溶液,分别稀释相同倍数,氨水的pH大于NaOH,方案二:取pH=a的氨水,稀释10倍后,氨水的pH大于a-1;
故答案为:NH3•H2O?NH4++OH-;取相同pH的氨水与NaOH溶液,分别稀释相同倍数,氨水的pH大于NaOH或取pH=a的氨水,稀释10倍后,氨水的pH大于a-1;
点评 本题考查了实验室制备方法、微粒的检验方法、实验制备方法和弱电解质电离平衡的分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 钢管与电源正极连接,钢管不易被腐蚀 | |
| B. | 通常情况下,钢管的电化腐蚀主要是吸氧腐蚀 | |
| C. | 钢管与铜管露天堆放在一起,钢管不易被腐蚀 | |
| D. | 钢管发生析氢腐蚀时,负极反应是Fe-3e→Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验步骤和结论 |
| ① | 比较浓度均为0.1mol•L-1的A和E的pH的大小为:7<A<E |
| ② | 1L pH=9的A分别与x L 0.001mol•L-1 B,y L 0.001mol•L-1D充分反应后,当溶液均呈中性时x、y的大小关系为:y<x; |
| ③ | pH=a的C与pH=b的D,且a+b=14,等体积混合发生酸碱中和反应后,溶液呈碱性. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
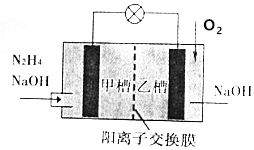 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )| A. | 电池工作时,正极附近的pH降低 | |
| B. | 当消耗1molO2时,有2molNa+由甲槽向乙槽迁移 | |
| C. | 负极反应为4OH-+N2H4-4e-=N2↑+4H2O | |
| D. | 若去掉离子交换膜电池也能正常工作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z>Y>X | B. | 氢化物的稳定性:Z>X | ||
| C. | Z的最高价氧化物可用于漂白 | D. | X与Y形成的化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol羟基 ( 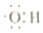 ) 中含有的电子数为0.7NA ) 中含有的电子数为0.7NA | |
| B. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA | |
| C. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COC-数目为NA | |
| D. | 14g乙烯与丙烯混合气体中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | 阴极的反应式是:H2O+2e-=H2+O2-、CO2+2e-=CO+O2- | |
| B. | X是电源的负极 | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量 Na2CO3 和 NaHCO3 分别和足量盐酸反应,相同条件下前者生成 CO2 少 | |
| B. | 将石灰水分别加入 NaHCO3 和 Na2CO3 中,前者不生成沉淀 | |
| C. | 相同条件下 Na2CO3 比 NaHCO3 更易溶于水 | |
| D. | Na2CO3 固体中含少量 NaHCO3,可用加热法除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com