
| A. | 3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | H-N | N═N |
| 键能/kJ•mol | 436 | 391 | 946 |
| A. | +1472kJ•mol-1 | B. | -1472kJ•mol-1 | C. | +92kJ•mol-1 | D. | -92kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物稳定性:PH3>H2S>HCl | B. | 沸点:H2O>HF>HCl | ||
| C. | 原子半径:S>F>O | D. | 酸性:HClO>HNO3>H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
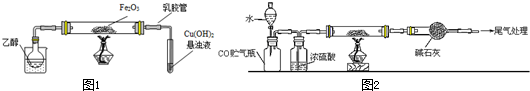
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与H2O反应过程中有离子键、非极性键、极性键的断裂和形成 | |
| B. | 1molNH4+中含有的共用电子对为3mol | |
| C. | N2属于单质,不存在化学键 | |
| D. | 离子化合物中一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | 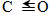 | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 876 | 465 | 413 |
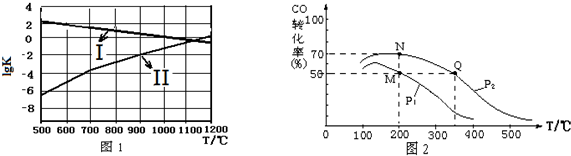
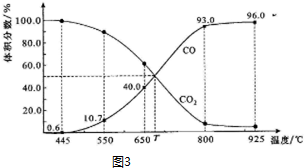
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com