
| ÎïÖÊ | A£¨g£© | B£¨g£© | C£¨g£© |
| ÎïÖʵÄÁ¿/mol | 1.2 | 0.6 | 0.6 |
| A¡¢·´Ó¦Ç°20 sÄÚµÄƽ¾ù·´Ó¦ËÙÂÊΪv£¨A£©=0.6 mol?L-1?s-1 |
| B¡¢20 sʱ£¬Ơư·´Ó¦ËÙÂÊ´óÓÚÄæ·´Ó¦ËÙÂÊ |
| C¡¢´ïµ½Æ½ºâʱ£¬A£¨g£©µÄת»¯ÂÊΪ100% |
| D¡¢ÈôÉư¸ßζÈƽºâ³£Êư±äΪ2£¬Ộ·´Ó¦µÄ¡÷H£¼0 |
| 1.2mol |
| 2L¡Á20s |
| ||||
(
|



| Ä꼶 | ¸ßÖĐ¿Î³̀ | Ä꼶 | ³ơÖĐ¿Î³̀ |
| ¸ß̉» | ¸ß̉»Ăâ·Ñ¿Î³̀ÍƼö£¡ | ³ở» | ³ở»Ăâ·Ñ¿Î³̀ÍƼö£¡ |
| ¸ß¶₫ | ¸ß¶₫Ăâ·Ñ¿Î³̀ÍƼö£¡ | ³ơ¶₫ | ³ơ¶₫Ăâ·Ñ¿Î³̀ÍƼö£¡ |
| ¸ßÈư | ¸ßÈưĂâ·Ñ¿Î³̀ÍƼö£¡ | ³ơÈư | ³ơÈưĂâ·Ñ¿Î³̀ÍƼö£¡ |
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º

| ̉ơÀë×Ó Ksp ÑôÀë×Ó | CO32- | F- | OH- |
| Ca2+ | 5.0¡Á10-9 | 1.5¡Á10-10 | 4.7¡Á10-6 |
| Mg2+ | 3.8¡Á10-6 | 7.4¡Á10-11 | 5.6¡Á10-12 |
| Mn2+ | 2.2¡Á10-11 | 5.3¡Á10-3 | 2.1¡Á10-13 |
| Zn2+ | 1.2¡Á10-10 | 3.0¡Á10-2 | 6.9¡Á10-17 |
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
| ³äµç |
| ·Åµç |

²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
| A¡¢ÓëNaOH·´Ó¦µÄÂÈÆø̉»¶¨Îª0.25 mol |
| B¡¢n£¨Na+£©£ºn£¨Cl-£©¿ÉÄÜΪ7£º3 |
| C¡¢Èô·´Ó¦ÖĐת̉Ƶĵç×ÓΪn mol£¬Ộ0.30£¼n£¼0.45 |
| D¡¢n£¨NaCl£©£ºn£¨NaClO£©£ºn£¨NaClO3£©¿ÉÄÜΪ11£º1£º2 |
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
 ½«1.66g̀¼ËáÄƺÍÇâÑơ»¯ÄƵĹ̀̀å»́ºÏÎïÍêÈ«ÈÜÓÚË®£¬Åä³ÉÏ¡ÈÜ̉º£¬È»ºóỊ̈¸ĂÈÜ̉ºÖĐÖđµÎ¼ÓÈë1mo1?L-1µÄÑÎËᣬËù¼ÓÈëÑÎËáµÄ̀å»ưÓë²úÉúCO2µÄ̀å»ư£¨±ê×¼×´¿ö£©¹ØϵÈçͼËùʾ£®
½«1.66g̀¼ËáÄƺÍÇâÑơ»¯ÄƵĹ̀̀å»́ºÏÎïÍêÈ«ÈÜÓÚË®£¬Åä³ÉÏ¡ÈÜ̉º£¬È»ºóỊ̈¸ĂÈÜ̉ºÖĐÖđµÎ¼ÓÈë1mo1?L-1µÄÑÎËᣬËù¼ÓÈëÑÎËáµÄ̀å»ưÓë²úÉúCO2µÄ̀å»ư£¨±ê×¼×´¿ö£©¹ØϵÈçͼËùʾ£®²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
 ÔÚÈƯ»ưΪ2.0LµÄĂܱƠÈƯÆ÷ÖĐ£¬ÎïÖÊDÔÚT¡æʱ·¢Éú·´Ó¦£¬Ä³·´Ó¦ÎïºÍÉú³ÉÎïµÄÎïÖʵÄÁ¿Ëæʱ¼ätµÄ±ä»¯¹ØϵÈçͼ£®
ÔÚÈƯ»ưΪ2.0LµÄĂܱƠÈƯÆ÷ÖĐ£¬ÎïÖÊDÔÚT¡æʱ·¢Éú·´Ó¦£¬Ä³·´Ó¦ÎïºÍÉú³ÉÎïµÄÎïÖʵÄÁ¿Ëæʱ¼ätµÄ±ä»¯¹ØϵÈçͼ£®²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
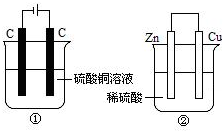 ÈçͼÁ½¸ö×°ÖĂÖĐ£¬̉º̀å̀å»ư¾ùΪ200mL£¬¿ªÊ¼¹¤×÷Ç°µç½âÖÊÈÜ̉ºµÄŨ¶È¾ùΪ0.5mol/L£¬¹¤×÷̉»¶Îʱ¼äºó£¬²âµĂÓĐ0.02molµç×Óͨ¹ư£¬ÈôºöÂÔÈÜ̉º̀å»ưµÄ±ä»¯£¬ÏÂÁĐĐđÊöƠưÈ·µÄÊÇ£¨¡¡¡¡£©
ÈçͼÁ½¸ö×°ÖĂÖĐ£¬̉º̀å̀å»ư¾ùΪ200mL£¬¿ªÊ¼¹¤×÷Ç°µç½âÖÊÈÜ̉ºµÄŨ¶È¾ùΪ0.5mol/L£¬¹¤×÷̉»¶Îʱ¼äºó£¬²âµĂÓĐ0.02molµç×Óͨ¹ư£¬ÈôºöÂÔÈÜ̉º̀å»ưµÄ±ä»¯£¬ÏÂÁĐĐđÊöƠưÈ·µÄÊÇ£¨¡¡¡¡£©| A¡¢²úÉúÆø̀å̀å»ư ¢Ù=¢Ú |
| B¡¢¢ÙÖĐ̉ơ¼«ÖÊÁ¿Ôö¼Ó£¬¢ÚÖĐƠư¼«ÖÊÁ¿¼ơĐ¡ |
| C¡¢ÈÜ̉ºµÄpH±ä»¯£º¢Ù¼ơĐ¡£¬¢ÚÔö´ó |
| D¡¢µç¼«·´Ó¦Ê½£º¢ÙÖĐÑô¼«£º4OH--4e-=2H2O+O2¡ü¢ÚÖиº¼«£º2H++2e-=H2¡ü |
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
 2013Äê3ÔÂÎ̉¹ú¿Æѧ¼̉±¨µÀÁËÈçͼËùʾµÄË®ÈÜ̉ºï®Àë×Óµç³Ø̀åϵ£®̉ÑÖª³äµçʱµç³Ø×Ü·´Ó¦Îª£ºLiMn2O4¨TLi1-xMn2O4+xLi£¬ÏÂÁĐĐđÊöƠưÈ·µÄÊÇ£¨¡¡¡¡£©
2013Äê3ÔÂÎ̉¹ú¿Æѧ¼̉±¨µÀÁËÈçͼËùʾµÄË®ÈÜ̉ºï®Àë×Óµç³Ø̀åϵ£®̉ÑÖª³äµçʱµç³Ø×Ü·´Ó¦Îª£ºLiMn2O4¨TLi1-xMn2O4+xLi£¬ÏÂÁĐĐđÊöƠưÈ·µÄÊÇ£¨¡¡¡¡£©| A¡¢·Åµçʱ£¬Ơư¼«·´Ó¦ÎªxLi++xe-¨TxLi |
| B¡¢·Åµçʱ£¬a¼«ï®µÄ»¯ºÏ¼Û²»·¢Éú±ä»¯ |
| C¡¢³äµçʱ£¬b¼«·¢ÉúÑơ»¯·´Ó¦ |
| D¡¢³äµçʱ£¬ÈÜ̉ºÖеÄLi+´Ób¼«Ị̈a¼«Ç¨̉Æ |
²é¿´´đ°¸ºÍ½âÎö>>
¿ÆÄ¿£º¸ßÖĐ»¯Ñ§ À´Ô´£º ̀âĐÍ£º
 £¨1£©25£®Cʱ£¬0.1mol/LµÄHAÈÜ̉ºÖĐ
£¨1£©25£®Cʱ£¬0.1mol/LµÄHAÈÜ̉ºÖĐ| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| A- |
²é¿´´đ°¸ºÍ½âÎö>>
°Ù¶ÈÖÂĐÅ - Á·Ï°²áÁбí - ÊỒâÁбí
º₫±±Ê¡»¥ÁªÍøÎ¥·¨ºÍ²»Á¼ĐÅÏ¢¾Ù±¨Æ½̀¨ | ÍøÉÏÓĐº¦ĐÅÏ¢¾Ù±¨×¨Çø | µçĐÅƠ©Æ¾Ù±¨×¨Çø | ÉæÀúÊ·ĐéÎ̃Ö÷̉åÓĐº¦ĐÅÏ¢¾Ù±¨×¨Çø | ÉæÆóÇÖȨ¾Ù±¨×¨Çø
Î¥·¨ºÍ²»Á¼ĐÅÏ¢¾Ù±¨µç»°£º027-86699610 ¾Ù±¨ÓÊÏ䣺58377363@163.com