
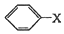
 +CH2═CH-M$→_{碱}^{Pb}$
+CH2═CH-M$→_{碱}^{Pb}$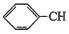 =CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
=CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: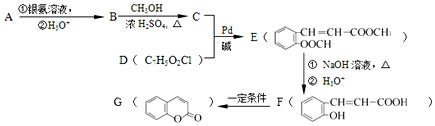
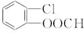 .
.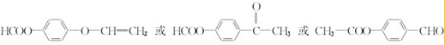 中任意2种.
中任意2种.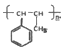 的路线流程图:
的路线流程图: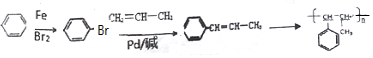 .
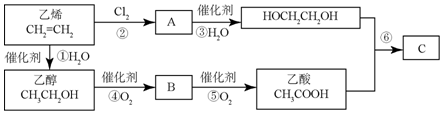
. 分析 由有机物A合成G(香豆素)的路线可知,结合E的结构可知,A中含3个C原子,C中含4个C原子,A能与银氨溶液反应,则A为CH2=CHCHO,B为CH2=CHCOOH,B与甲醇发生酯化反应生成C,则C的结构简式为:CH2=CHCOOCH3,结合已知信息可知C+D→E,由E的结构可知,D为 ,E→F发生水解,F→G发生酯化反应,以此解答(1)~(4);
,E→F发生水解,F→G发生酯化反应,以此解答(1)~(4);
(5)以苯和丙烯为原料,合成  ,苯先发生取代反应生成溴苯,再与丙烯发生取代反应,最后发生加聚反应,以此来解答.
,苯先发生取代反应生成溴苯,再与丙烯发生取代反应,最后发生加聚反应,以此来解答.
解答 解:(1)A为CH2=CHCHO,名称为丙烯醛,D为 ,故答案为:丙烯醛;
,故答案为:丙烯醛; ;
;
(2)C为CH2=CHCOOCH3,官能团名称为酯基、碳碳双键,F→G 中-COOC-转化为-COOH,反应类型是取代反应或水解反应,
故答案为:酯基、碳碳双键;取代反应或水解反应;
(3)A和银氨溶液反应的化学方程式为CH2=CHCHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH2=CHCOONH4+2Ag↓+H2O+3NH3↑,E中2个-COOC-及水解生成的1个酚-OH均与NaOH反应,则1molE最多能和3 mol NaOH发生反应,
故答案为:CH2=CHCHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH2=CHCOONH4+2Ag↓+H2O+3NH3↑;3;
(4)F的同分异构体满足Ⅰ.分子中除苯环外,无其他环状结构;Ⅱ.苯环上有两个处于对位的取代基;Ⅲ.能发生水解反应,不能与金属Na反应;Ⅳ.能与新制的Cu(OH)2按物质的量之比1:2发生反应,则含-COOC-、-CHO或HCOOC-、-C-O-C-CH=CH2或HCOOC-、-COCH3,符合条件的同分异构体为 或
或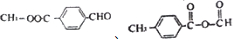 ,
,
故答案为: 中任意2种;
中任意2种;
(5)以苯和丙烯为原料,合成  ,苯先发生取代反应生成溴苯,再与丙烯发生取代反应,最后发生加聚反应,合成流程为
,苯先发生取代反应生成溴苯,再与丙烯发生取代反应,最后发生加聚反应,合成流程为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握流程中官能团的变化、碳链变化、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
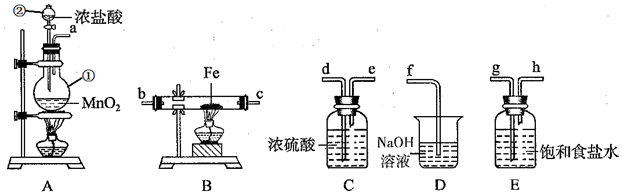
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
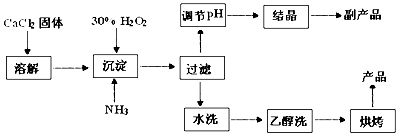
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
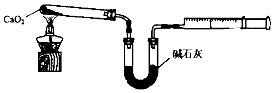
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
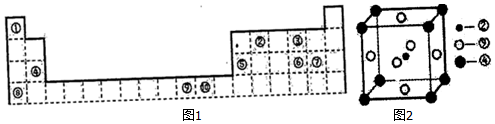
| 元素编号 | A | B | C | D | E | F | G | H | I |
| 原子半径/nm | 0.037 | 0.071 | 0.074 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高或最 低化合价 | +1 | -1 | -2 | -3 | +3 | -2 | +3 | +1 | +1 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①④ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第30min时,A的反应速率为0.05 mol•L-1•min-1 | |
| B. | 30min内,C的平均反应速率为0.02 mol•L-1•min-1 | |
| C. | 30min内,V(B)=$\frac{1}{3}$V(A) | |
| D. | 30min内,该反应放出的热量为3b kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度,可提高反应速率 | |
| B. | 加入合适的催化剂,可提高N2的转化率 | |
| C. | N2的正反应速率等于NH3的逆反应速率 | |
| D. | 反应物和生成物的浓度都不再发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com