
关于化学平衡常数的叙述正确的是( )
A.温度一定,一个化学反应的平衡常数与反应物浓度成正比
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.浓度商Q<K,v正<v逆
科目:高中化学 来源: 题型:
PVC是聚氯乙烯的英文缩写,为保证PVC塑料制品的性能,通常需要加入多种有机助剂。下列选项中的事实均能支持“PVC保鲜膜对人体健康带来危害”假设的是( )
①PVC塑料属于高分子材料 ②加入的有机助剂有毒 ③含氯的化合物不一定有毒 ④在高温下会分解出有害物质
A.①② B.③④ C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
( )。
A.不管什么反应使用催化剂,都可以加快反应速率
B.可逆反应A(g)  B(g)+C(g),增大压强正反应速率和逆反应速率增大
B(g)+C(g),增大压强正反应速率和逆反应速率增大
C.对达到平衡的一个放热的可逆反应,若降低温度正反应速率减小,逆反应速率增大
D.参加反应物质的性质是决定化学反应速率的主要因素
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应A+B—→C,如果温度每升高10 ℃,反应速率增加为原来的3倍。在10 ℃时,完成反应的20%需要54 min;将温度提高到40 ℃,完成反应的20%需要的时间为( )
A.2 min B.3 min
C.6 min D.9 min
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应2AB+D在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表。
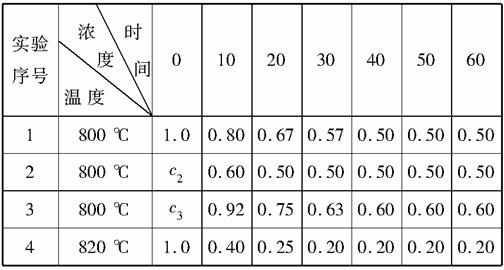
据上表,回答下列问题。
(1)在实验1中,反应物A在10~20分钟时间内平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_________________
____________________________________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______(填“>”、“=”或“<”,下同)v1,且c3________1.0 mol·L-1。
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”、“放热”)。理由是___________________________________
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应A+B—→C,如果温度每升高10 ℃,反应速率增加为原来的3倍。在10 ℃时,完成反应的20%需要54 min;将温度提高到40 ℃,完成反应的20%需要的时间为( )
A.2 min B.3 min
C.6 min D.9 min
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应2AB+D在四种不同的条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表。
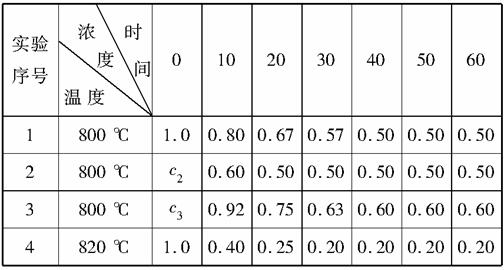
据上表,回答下列问题。
(1)在实验1中,反应物A在10~20分钟时间内平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是_________________
____________________________________________________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3______(填“>”、“=”或“<”,下同)v1,且c3________1.0 mol·L-1。
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”、“放热”)。理由是___________________________________
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是 ( )。
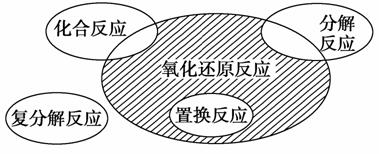
A.Cl2+2KBr===Br2+2KCl
B.2NaHCO3Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O===4Fe(OH)3
D.2Na2O2+2CO2===2Na2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容。
已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是

(1)酪氨酸能发生的化学反应类型有________。
A.取代反应 B.氧化反应
C.酯化反应 D.中和反应
(2)已知氨基酸能与碱反应,写出酪氨酸与足量的
NaOH溶液反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)写出酪氨酸自身反应形成二肽的方程式:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com