

| ||
| △ |
| ||
| △ |
| ||
| ||
| ||
| △ |
| ||
| △ |
| ||
| ||


科目:高中化学 来源: 题型:
 如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:
如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示:| 纯A(单质) | B溶液 | C固体 | D固体 | G溶液 | |
| 颜色 | 银白色 | 黄色 | 红褐色 | 红棕色 | 浅绿色 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
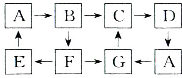
| 物质 | A单质 | B溶液 | C固体 | D固体 | G溶液 |
| 颜色 | 银白色 | 黄色 | 红褐色 | 红棕色 | 浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
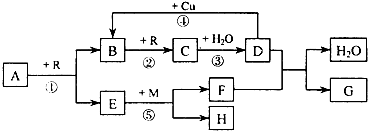
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com