
| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol/LNa2CO3溶液加热后,溶液的PH减小 | |
| C. | 中和滴定时,滴定管用所盛装的反应液润洗2〜3次 | |
| D. | 室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强 |
分析 A、氢氧燃料电池中,H2在负极上失去电子;
B、加热促进碳酸根离子的水解,使得氢氧根离子浓度增大;
C、为减小误差,滴定管用所盛装的反应液润洗;
D、电解质的导电能力与溶液中自由移动阴阳离子的浓度有关.
解答 解:A、氢氧燃料电池中,H2在负极上失去电子被氧化,故A正确;
B、Na2CO3溶液加热,促进碳酸根离子的水解,使得氢氧根离子浓度增大,溶液的pH增大,故B错误;
C、为防止液体被稀释而导致浓度减小而产生实验误差,滴定管用所盛装的反应液润洗2〜3次,故C正确;
D、电解质的导电能力与溶液中自由移动阴阳离子的浓度有关,稀释0.1mol•L-1CH3COOH溶液,使得离子浓度减小,导电能力减弱,故D错误.
故选AC.
点评 本题考查了原电池基本原理、盐类水解的影响因素、误差分析和导电能力强弱的判断,综合性强,但是较为基础,掌握基本原理是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
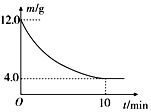 在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )
在一定的条件下,向2L密闭容器中进行一定量MgSO4和CO的反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g).反应时间与残留固体的质量关系如图所示. 下列说法正确的是( )| A. | 升高温度时,正反应速率增大,逆反应速率减小 | |
| B. | 随着反应的进行,混合气体的平均相对分子质量增大 | |
| C. | 增加硫酸镁的质量时,正反应速率将增大 | |
| D. | 在 0~10min内,v(CO)=0.01mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱 | |
| C. | 钾与水的反应比钠与水的反应更剧烈 | |
| D. | 因为非金属性Cl>S,盐酸的酸性比氢硫酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象 | 离子方程式 |
 | ①溶液分层 ②下层呈橙色. | Cl2+2Br-═Br2+2Cl- |
 | ①溶液分层 ②下层呈紫色 | Br2+2I-=I2+2Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com