
| A.Fe2(SO4)3 | B.NaCl | C.KNO3 | D.Cu(NO3)2 |
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:不详 题型:单选题
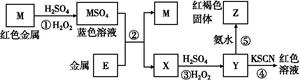
| A.E3+的氧化性比M2+的氧化性弱 |
| B.在反应①中硫酸既表现了酸性、又表现了氧化性 |
C.反应④的离子方程式可表示为:3SCN-+E3+ E(SCN)3↓ E(SCN)3↓ |
| D.在③反应中若不加稀硫酸可能看到红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
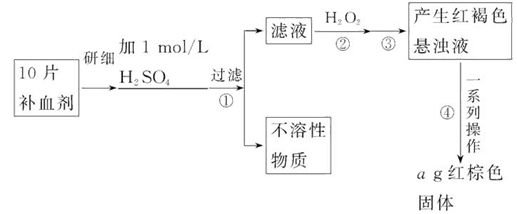
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu、Fe3+、Fe | B.Fe2+、Fe3+、Fe |
| C.Cu、Cu2+、Fe | D.Cu、Fe2+、Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3O4是—种红棕色粉末,俗称磁性氧化铁 |
| B.铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C.去除FeCl2溶液中的FeCl3杂质可以向溶液中加入过量铁粉,然后过滤 |
| D.Fe3+与KSCN反应产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
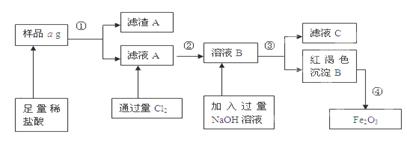
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物总质量为13.6 g |
| C.反应后的固体混合物中氧化物的物质的量为0.05 mol |
| D.反应后的固体混合物中单质Cu的质量为12.8 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
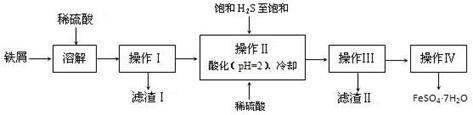
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com