
| 1mol |
| 4.5mol |
| 2 |
| 9 |
| 2 |
| 9 |
| 0.5mol |
| 1mol |
| 1mol |
| 4.5mol |
| 2 |
| 9 |
| 2 |
| 9 |
| 1mol |
| 4.5mol |
| 2 |
| 9 |
| 2 |
| 9 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
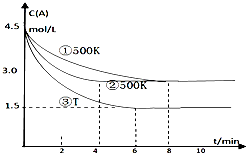 某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示.
某反应2A(g)?2B(g)+C(g)(吸热反应)在三种不同条件下进行,B、C的起始浓度为0,A的浓度(mol/L)随反应时间(min)的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
 密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则:
密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图.则:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.
过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
1 1 |
2 1 |
3 1 |
23 12 |
24 12 |
65 29 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com