
【题目】氨及铵盐都是重要的化工原料。
I.某兴趣小组制取氨气并探究氨的催化氧化实验。
(1)实验室制取氨气的化学反应方程式为_________________。
(2)如图,分别从A、B两管口通入干燥的氨气和氧气,为保证在装置3中观察到红棕色气体,装置2应装入________;若取消装置2,在装置3中仅观察到大量白烟,原因是______________。
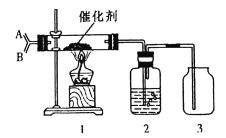
(3)氨气常用于检验化工生产中氯气是否泄漏,因为氯气有少量泄漏时用氨气检验会有白烟生成,同时生成一种对大气无污染的产物,试写出该反应的化学方程式:_________________。
Ⅱ.(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同。
【实验探究】该小组拟选用下图所示装置进行实验(夹持和加热装置略)
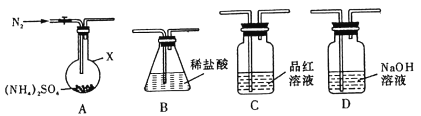
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5 mol/L盐酸70 mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,用0.2 mol/L NaOH溶液中和剩余盐酸,消耗NaOH溶液25 mL。经检验中和后的溶液中无SO42-。
(4)装置B内溶液吸收气体的物质的量是_________mol。
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-、无SO42-,进一步研究发现,气体产物中无氮氧化物。
(5)检验装置D内溶液中有SO32-、无SO42-的实验操作和现象是:___________________。
(6) (NH4)2SO4在400℃分解的化学方程式是__________________。
【答案】 2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 浓H2SO4 生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3 8NH3+3Cl2=N2+6NH4 C1 0. 03 取少量装置D内溶液于试管中(取样),滴加BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体 3(NH4)2 SO4
CaCl2+2H2O+2NH3↑ 浓H2SO4 生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3 8NH3+3Cl2=N2+6NH4 C1 0. 03 取少量装置D内溶液于试管中(取样),滴加BaCl2溶液,生成白色沉淀;加入足量稀盐酸后沉淀完全溶解,放出无色刺激性气体 3(NH4)2 SO4![]() 4NH3↑+N2↑+3SO2↑+6H2O↑
4NH3↑+N2↑+3SO2↑+6H2O↑
【解析】I. (1)实验室用氯化铵和氢氧化钙加热制取氨气,反应的化学反应方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(2)分别从A、B两管口通入干燥的氨气和氧气,为保证在装置3中观察到红棕色气体,需要用浓硫酸除去未反应的氨气,防止氨气与一氧化氮在空气中生成的硝酸蒸汽反应,否则,在装置3中仅观察到大量白烟硝酸铵,故答案为:浓H2SO4;生成的NO与O2反应生成NO2,NO2与水反应生成HNO3,NH3与HNO3反应生成了NH4NO3;
(3)氯气有少量泄漏时用氨气检验会有白烟生成,同时生成一种对大气无污染的产物,应该是氮气,反应的化学方程式为8NH3+3Cl2=N2+6NH4 C1,故答案为:8NH3+3Cl2=N2+6NH4 C1;
Ⅱ.(4)滴定剩余盐酸,终点时消耗NaOH为0.025L×0.2mol/L=0.005mol,故剩余HCl为0.005mol,则参加反应的HCl为0.07L×0.5mol/L-0.005mol=0.03mol,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=NH4Cl,故吸收NH3的物质的量为0.03mol,故答案为:0.03;
(5)检查装置D内溶液中有SO32-,无SO42-的实验操作和现象是:取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-,故答案为:取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-;
(6)装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,分解反应方程式为:3(NH4)2SO4![]() 4NH3↑+3SO2↑+6H2O↑+N2↑,故答案为:3(NH4)2SO4
4NH3↑+3SO2↑+6H2O↑+N2↑,故答案为:3(NH4)2SO4![]() 4NH3↑+3SO2↑+6H2O↑+N2↑。
4NH3↑+3SO2↑+6H2O↑+N2↑。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的质量的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的质量的量分别为4mol、2mol和4mol,保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A. 均减半 B. 均加倍 C. 均减少1mol D. 均增加1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:钠、Br2、CO2、SO3、NH3、H2S、硫酸、醋酸、Ba(OH)2、NH3·H2O、氯化钠、硫酸钡、乙醇、盐酸、蔗糖、胆矾,属于电解质、非电解质、强电解质的分别有
A. 9种、7种、6种 B.9种、5种、6种
C. 7种、5种、4种 D.8种、5种、5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 1.01×105Pa、150℃条件下,某烃完全燃烧,反应前后压强不发生变化,该烃可能是( )
A. C2H4 B. C3H8 C. C2H6 D. C2H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸的质量分数为36.5%,密度为1.20 g/cm3。现用该浓盐酸配制100 mL 3.00 mol/L的盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀盐酸时,上述仪器中不需要使用的有_________(选填序号),还缺少的仪器有_________(仪器名称)。
(2)经计算,配制100 mL 3.00 mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为_________mL(保留一位小数),量取浓盐酸时应选用_________(选填①10 mL、②50 mL、③100 mL的序号)规格的量筒。
(3)用配制所得100mL该稀盐酸与过量的铁屑充分反应,可制得氢气_________L(标准状况)。将生成的FeCl2配制成500 mL溶液,所得溶液中FeC12的物质的量浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.01 mol·L-1 MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1 C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
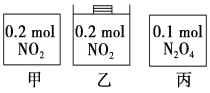
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
①Mg(Al)
试剂:________;离子方程式:_____________________。
②CO2(HCl)
试剂:________;离子方程式:_____________________。
(2)把下列离子方程式改写成化学方程式。
①2H++CO![]() CO2↑+H2O_____________________。
CO2↑+H2O_____________________。
②Al3++3OH—Al(OH)3↓_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施,是为了防止产生雾霾的,其中不可行的是
A. 停止冬季供暖,减少有害物质排放
B. 对锅炉和汽车等产生的有害气体和烟尘等进行处理
C. 退耕还林,改善生态环境
D. 寻找新能源,减少化石燃料的使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com