
 工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是( )已知:①Ni2+在弱酸性溶液中发生水解 ②氧化性:| A、碳棒上发生的电极反应:4OH--4e-═O2↑+2H2O |
| B、电解过程中,B中NaCl溶液的物质的量浓度将不断减少 |
| C、为了提高Ni的产率,电解过程中需要控制废水pH |
| D、若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、氯化铁溶液与氢氧化钠溶液:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
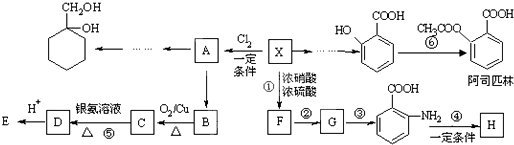

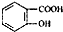 的同分异构体的结构简式
的同分异构体的结构简式 ,请设计合成路线,要求不超过4步(无机试剂任选)
,请设计合成路线,要求不超过4步(无机试剂任选)| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 |
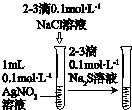 |
 |
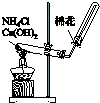 |
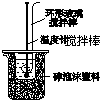
| A.配制100mL 0.1mol/L盐酸 |
B. 验证AgCl和Ag2S的溶解性 | C.测定中和反应 的反应热 |
D.实验室制取 并收集氨气 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
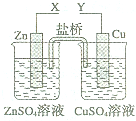
| A、X和Y与电流表连接,将Zn换成Fe,测得电流更大 |
| B、X和Y与电流表连接,将盐桥换成铜线,电流表指针偏转 |
| C、X和Y分别与电源“+”、“-”极相连,Cu极质量增大 |
| D、X和Y分别与电源“-”、“+”极相连,盐桥中阴离子向Zn极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减少CO2的排放,可以减少酸雨的产生 |
| B、减少SO2的排放,可以从根本上消除雾霾 |
| C、“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| D、用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
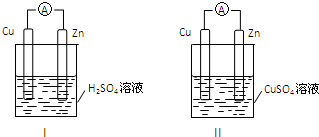
| A、装置I,铜片上有O2逸出 |
| B、装置I,锌片溶解,发生还原反应 |
| C、装置Ⅱ,电池反应为:Zn+Cu2+═Zn2++Cu |
| D、装置Ⅱ,外电路中,电子从锌电极流向铜电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9mol/L |
| B、pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C、同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大 |
| D、0.1mol/L Na2CO3溶液和0.1mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的还原剂是Cu2S |
| B、当1mol O2发生反应时,还原剂所失去电子的物质的量为4mol |
| C、O2发生了氧化反应 |
| D、CuSO4即是氧化产物,又是还原产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com