
| A. | 镀锌铁皮在食盐水中发生析氢腐蚀 | |
| B. | 电解池的阴极材料一定比阳极材料活泼 | |
| C. | 将铁器与电源正极相连,可在其表面镀锌 | |
| D. | 原电池的负极和电解池的阳极均发生氧化反应 |
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为:2NH3-6e-=N2+6H+ | |
| D. | 当有4.48LNO2被处理时,转移电子数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 晶体 | NaCl | KCl | CaO |
| 晶格能/(Kj.mol-1) | 786 | 715 | 3401 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO用于冶炼金属镁 | B. | NaCl用于制纯碱 | ||
| C. | Cu(OH)2用于检验糖尿病 | D. | FeCl3用于净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中还原产物只有SO2 | |
| B. | 反应②中Cu2S只发生了氧化反应 | |
| C. | 将1 molCu2S冶炼成 2mol Cu,需要O21mol | |
| D. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
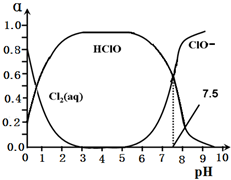 元素周期表中ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中ⅦA族元素的单质及其化合物的用途广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )| A. | 由图中信息可知 HA为强酸,N点为恰好中和 | |
| B. | 常温下一定浓度的 MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13,c(HA)+c(A-)=0.25mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L乙醇完全燃烧所耗的氧气分子数为3NA | |
| B. | 0.5molC3H8分子中所含C-H共价键数为2NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| D. | 1mol碳正离子CH3+所含的电子数为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com