
【题目】SO2是主要大气污染物之一,工业上可用如图装置吸收转化SO2(A、B 为惰性电极)。下列说法错误的是( )

A. a为电源的正极
B. B 极上发生氧化反应
C. 离子交换膜为阳离子交换膜
D. A极区溶液的pH逐渐增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】金刚石、石墨、C60和石墨烯都是碳的同素异形体,其结构示意图如下:
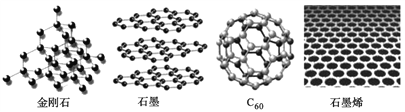
(1)石墨晶体中存在的作用力有________________________________
(2)金刚石质硬但脆,金刚石能被砸碎的原因是___________________________;金刚石、石墨、C60的熔点由高到低的顺序是________________________。
(3)C60晶体的堆积方式为______________;晶体中C60的配位数为_________。
(4)石墨烯具有神奇的特性,两位科学家由于对石墨烯研究做出重大贡献而获得了2010年诺贝尔物理学奖。石墨烯即单层石墨。石墨烯中碳原子的杂化轨道类型为_______________;碳碳键的键角是_________;碳原子和碳碳键的个数比是_______;12g石墨烯中含有________个六元环。
(5)碳化硅的结构与金刚石类似,设碳化硅的密度为a g/cm3,碳化硅晶体内碳硅键的键长为______pm(用NA表示阿伏加德罗常数的值,列表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:

下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 常温下32g含有少量臭氧的氧气中,共含有2NA个氧原子
C. 56g铁粉 与足量水蒸气反应,转移的电子数为3NA
D. 100mL0.1mol/L醋酸溶液含有的氢离子数为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则x值是
A. 5 B. 4 C. 3 D. 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,要进行必要的处理。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ: 取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1 Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3![]() 2NaI+Na2S4O6)
2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | 18.20 |
步骤Ⅳ:将上述反应后溶液进行pH调节、过滤等处理,回收沉淀,滤液倒入下水道。
(1)步骤Ⅰ加入稀硫酸酸化的目的是_____________________________;
(2)步驟Ⅱ判断滴定达到终点的现象是___________________________;
(3)以下操作会造成废水中铬含量测定值偏高的是_________________;
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72- 的物质的量为___________mol.
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:

(5)能说明第①步反应达到平衡状态的是_____________;(填字母代号)
a. Cr2O72- 和CrO42- 的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c. 溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要________mol的FeSO4·7H2O。
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5 mol·L-1,溶液的pH应调至___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在科研、生活及化学工业中具有重要的作用。
(1)在废水处理领域中,H2S或Na2S能使某些金属离子生成极难溶的硫化物而除去。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发)。
pH | 3 | 5 | 7 | 9 | 11 |
c(S2-)/ (mol·L-1) | 1.4×10-15 | 1.4×10-11 | 6.8×10-8 | 1.3×10-5 | 1.3×10-3 |
某溶液含0.020 mol·L-1 Mn2+、0.10 mol·L-1 H2S,当溶液的pH=5时,Mn2+开始沉淀,MnS的溶度积为______。
(2)工业上采用高温分解H2S制取氢气,其反应为2H2S(g)![]() 2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
2H2(g)+S2(g) ΔH1,在膜反应器中分离出H2。
①已知:H2S(g)![]() H2(g)+S(g) ΔH2;2S(g)
H2(g)+S(g) ΔH2;2S(g)![]() S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
S2(g) ΔH3,则ΔH1=______ (用含ΔH2、ΔH3的式子表示)。
②在密闭容器中,充入0.10 mol H2S(g),发生反应2H2S(g)![]() 2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
2H2(g)+S2(g),控制不同的温度和压强进行实验,结果如图所示。
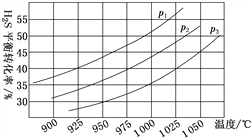
图中压强p1、p2、p3由大到小的顺序为______,理由是______。若容器的容积为2.0 L,则压强为p3,温度为950 ℃时,反应经3 h达到平衡,化学反应速率v(S2)=______;若压强p2=7.2 MPa、温度为975 ℃时,该反应的平衡常数Kp=______(用平衡分压代替平衡浓度,分压=总压×物质的量分数,计算结果保留两位有效数字)。若保持压强不变,升温至1000 ℃时,则该反应的平衡常数_____(填“增大”“不变”或“减小”)。
(3)工业上用惰性电极电解KHSO4饱和溶液制取H2O2,示意图如图所示:
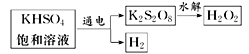
①低温电解KHSO4饱和溶液时阳极的电极反应式为______。
②K2S2O8水解时生成H2O2和KHSO4,该反应的化学方程式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com