
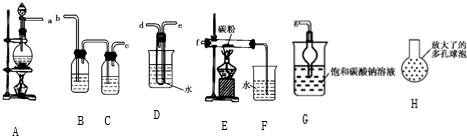
分析 Ⅰ.(1)A是利用浓盐酸和二氧化锰加热制取氯气的装置;
(2)将导管换成多孔球泡,能够增大气体与溶液的接触面积;
(3)氯气与碳酸钠溶液反应能够得到三种盐,应为氯化钠、次氯酸钠和碳酸氢钠;
Ⅱ.(4)D装置的作用是带出水蒸气,导管应长进短出;
(5)据氧化还原反应中得失电子守恒和原子守恒书写化学方程式,D的作用是让氯气带出水蒸气,烧杯中加入浓硫酸,浓硫酸溶于水放热,促进试管里的水蒸发,且气体的溶解度随温度的升高而减小;
(6)反应生成HCl,HCl是极易溶于水的气体;
Ⅲ.探究SO2具有漂白性用品红溶液,探究SO2具有还原性用酸性高锰酸钾.
解答 解:Ⅰ.(1)浓盐酸和二氧化锰加热生成氯气、氯化锰和水,反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)将导管换成多孔球泡,能够增大气体与溶液的接触面积,故答案为:增大了氯气与水的接触面积;
(3)氯气与碳酸钠溶液反应能够得到三种盐,应为氯化钠、次氯酸钠和碳酸氢钠,离子方程式为:Cl2+H2O+2CO32-═Cl-+ClO-+2HCO3-,
故答案为:Cl2+H2O+2CO32-═Cl-+ClO-+2HCO3-;
Ⅱ.(4)D装置的作用是带出水蒸气,导管应长进短出,故答案为:e;
(5)Cl2、水蒸气与碳粉发生氧化还原反应,生成两种气体,且体积比为1:4,则生成两种气体为HCl和CO2,反应方程式为2Cl2+2H2O(g)+C$\frac{\underline{\;△\;}}{\;}$4HCl+CO2,为使D中更快地产生水蒸气,在烧杯中加入浓硫酸,稀释时放出大量的热,促进试管里的水蒸发,减少氯气的溶解,
故答案为:2Cl2+2H2O(g)+C$\frac{\underline{\;△\;}}{\;}$4HCl+CO2;稀释时放出大量的热,促进试管里的水蒸发,减少氯气的溶解;
(6)反应生成大量HCl气体,其极易溶于水发生倒吸,所以需要改进,故答案为:E中产生的气体中含有大量极易溶于水的HCl气体,易引起倒吸;
Ⅲ.探究SO2具有漂白性用品红溶液,探究SO2具有还原性用酸性高锰酸钾,所以B中盛放品红溶液,C中盛放酸性高锰酸钾,证明SO2具有漂白性的现象为B中品红溶液褪色,故答案为:品红溶液;酸性高锰酸钾溶液;B中品红溶液褪色.
点评 本题通过氯气的制取和性质探究考查了氧化还原反应方程式书写、尾气处理等知识点,是高考必考知识点,注意常见气体的制取和性质实验.


科目:高中化学 来源: 题型:选择题
| A. | 干冰、铁、氯化氢 | B. | 生石灰、白磷、纯碱 | ||
| C. | 烧碱、液态氧、碘酒 | D. | 空气、氮气、胆矾(CuSO4•5H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 因为酸性HCl>H2S,判断硫、氯的非金属性强弱 | |
| C. | 稳定性CH4<SiH4,判断硅与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁片、石墨棒,酒精 | B. | 铜片、石墨棒,硝酸银溶液 | ||
| C. | 锌片、铜片,稀盐酸 | D. | 铜片、银片,FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
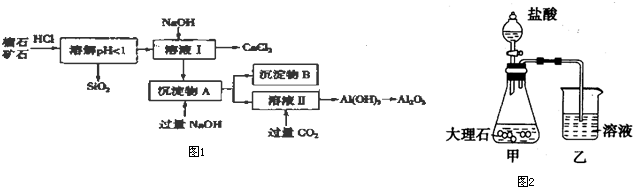
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 12.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com