
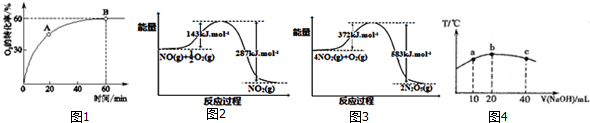
分析 (1)①根据图知,A点未达到平衡状态、B点达到平衡状态,从A点到B点平衡正向移动,则A点的正反应速率大于逆反应速率,B点正逆反应速率相等;
②平衡时压强转化率为60%,当n(NO):n(O2)=4:1时设NO为4,O2为1,结合化学平衡三行计算得到;当达到B点后往容器中再以4:1加入些NO和 O2,相当于中等容器中气体压强,平衡正向进行;
(2)依据图象分别写出对应反应的热化学方程式,结合盖斯定律计算4NO(g)+3O2(g)═2N2O5(g)反应的焓变;
(3)①②HNO2是弱酸,亚硝酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,据此确定c(NaOH);
③电离吸热,温度越高电离平衡常数越大;
④当c(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+).
解答 解:(1)①A到B点氧气的转化率增大,说明反应正向进行,A点的逆反应速率v逆 (O2)小于B点的正反应速率v正(O2),
故答案为:小于;
②平衡时压强转化率为60%,当n(NO):n(O2)=4:1时设NO为4,O2为1,则转化的氧气为0.6,结合化学平衡三行计算,
2NO(g)+O2(g)═2NO2(g)
起始量 4 1 0
变化量 1.2 0.6 1.2
平衡量 2.8 0.4 1.2
NO的平衡转化率$\frac{1.2mol}{4mol}$×100%=30%,
当达到B点后往容器中再以4:1加入些NO和 O2,相当于中等容器中气体压强,平衡正向进行,一氧化氮百分含量减小,NO的百分含量小于B点NO的百分含量,
故答案为:30%,小于;
(2)热化学方程式为①NO(g)+$\frac{1}{2}$O2(g)=NO2(g)△H=143KJ/mol-287KJ/mol=-144KJ/mol,
②4NO2(g)+O2(g)=2N2O5(g)△H=(372-583)KJ/mol=-211KJ/mol,
依据盖斯定律计算①×4+②得到4NO(g)+3O2(g)═2N2O5(g)△H=-787kJ/mol,
故答案为:-787kJ/mol;
(3)①HNO2是弱酸,次氯酸电离是吸热反应,酸碱中和反应是放热反应,当恰好完全中和时放出热量最多,c(NaOH)=$\frac{0.020L×0.01mol/L}{0.020L}$=0.01mol/L;
故①错误,②正确;
③电离吸热,温度越高电离平衡常数越大,所以HNO2的电离平衡常数:b点>a点,故③正确;
④从b点到c点,当C(NaOH)较大时,可能出现:c(Na+)>c(OH-)>c(NO2-)>c(H+),故④错误;
故答案为:②③.
点评 本题考查热反应方程式、化学平衡计算、化学平衡影响因素、化学平衡常数、反应速率计算等,侧重考查学生对图象与数据的分析及计算能力,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
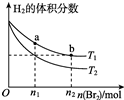 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)?2HBr(g)△H<0.当温度分别为T1、T2,达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A. | 由图可知:T1<T2 | |
| B. | a、b两点的正反应速率:b>a | |
| C. | 为了提高Br2(g)的转化率,可在其他条件不变时,将体积变为V/2 L | |
| D. | T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
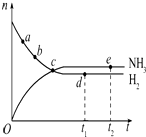 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
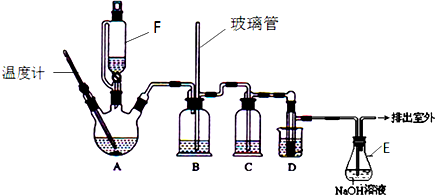
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com