
【题目】下列元素中非金属性最强的是( )
A.Mg
B.Na
C.F
D.Cl
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下表中列出了有关晶体的说明,错误的是( )
选项 | A | B | C | D |
晶体名称 | 氯化钾 | 氩 | 白磷(P4) | 烧碱 |
构成晶体微粒名称 | 阴、阳离子 | 原子 | 分子 | 阴、阳离子 |
晶体中存在的作用力 | 离子键 | 共价键、范德华力 | 共价键、范德华力 | 离子键、共价键 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某一可逆反应:A+B ![]() 2C达到化学平衡,下列说法正确的是( )
2C达到化学平衡,下列说法正确的是( )
A. 增加A的量,化学平衡向右移动 B. 温度升高,化学平衡一定会发生移动
C. 增大压强,缩小容器体积,化学平衡不移动 D. 添加MnO2,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种物质的溶液:①NaCl ②NH4Cl ③Na2CO3 ④Al2(SO4)3 ⑤CH3COOH ⑥NaHCO3。
(1)25℃时,0.1mol·L-1②溶液的pH________7(填“>”、“=”或“<”);其原因是______________________________________(用离子方程式表示);
(2)常温下,浓度均为0.1mol/L的③和⑥的溶液中离子种类________(填“相同”或是“不相同”);
(3)将④溶液加热蒸干并灼烧最终得到的物质是____________(填化学式);
(4)常温下0.1 mol/L的⑤溶液加水稀释过程中,下列表达式的数据一定变大的是_________。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是动植物生长不可缺少的元素,氨在自然界中的循环对生命有重要意义。其循环示意图如下:
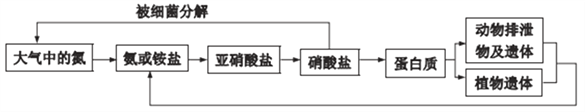
(1) 氨分子的电子式是__________。
(2) NH3是重要的化工原料,用途广泛,如合成尿素等。合成尿素原理分两步:
CO2(g)+ 2NH3(g)=NH2COONH4(s) △H1=- 159.5kJ/mol
NH2COONH4(s) = CO(NH2)2(s) + H2O(g) △H2=+28.5kJ/mol
则2NH3(g)+ CO2(g)=CO(NH2)2(s) + H2O(g) △H=_______kJ/mol
(3) 氯化铵也是氨的重要化合物,现有25℃时某浓度的氯化铵溶液中NH3·H2O和NH4+的浓度随pH的变化示意图如图I所示,则图中曲线①代表的是__________[填c(NH3·H2O)或c(NH4+)]该温度下NH3·H2O 电离平衡常数为___________(用a 的代数式表示)。
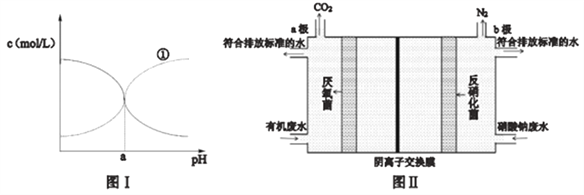
(4) 在厌氧环境下,土壤中的某些微生物(细菌)可将硝酸盐还原成氮气而实现自然界中的氮循环。某研究性学习小组由“自然界中的氮循环”产生联想:利用微生物的作用将化学能转化为电能即设计成微生物电池来同时处理含硝酸钠和有机物的废水,装置原理如图II(图中有机物用C6H12O6表示).写出电极b上的电极反应式__________________。
(5) 将游离态的氮转化为化合态的氮叫做氮的固定,其中一种重要的人工固氮就是合成氨。现维持温度为T压强为P的条件下,向一容积可变的密闭容器中通入1molN2和3molH2发生N2(g) +3H2(g)![]() 2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
2NH3(g)的反应。容器容积与反应时间的数据关系如下表:
时间/min | 0 | 5 | 10 | 20 | 40 | 80 |
容器 容积/L | 4.00V | 3.20V | 2.80V | 2.60V | 2.50V | 2.50V |
该条件下达平衡时H2的转化率α(H2)=______,平衡常数K=_________(用V表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 ③能与水在一定条件下反应生成有机物C |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③在Cu作催化剂且加热条件下能与O2反应 |
D | ①由C、H、O三种元素组成;②球棍模型为 ③能与C反应生成相对分子质量为100的酯 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是________________。
(2)写出在一定条件下,A发生聚合反应生成高分子化合物的化学方程式:_____________。
(3)B具有的性质是________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应 ⑦与溴水混合后液体分层且上层呈橙红色。
(4)由B制备硝基苯的化学方程式___________________________。
(5)C在铜作催化剂且加热条件下能与氧气反应的化学方程式_________________。
(6)D中官能团的名称为__________________________。
(7)D与C反应能生成相对分子质量为100的酯,该反应的反应类型为____________;其化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定的温度、压强和钒催化剂存在的条件下,SO2被空气中的O2氧化为SO3。V2O5是钒催化剂的活性成分,郭汗贤等提出:V2O5在对反应I的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,图示如图1:
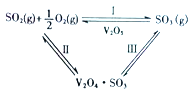
图1
(1)①已知有关气体分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | O=O(O2) | S=O(SO3) |
能量/kJ | 535 | 496 | 472 |
由此计算反应Ⅰ的△H=_________kJ·mol-1。
②写出反应Ⅱ的化学方程式_________。
(2)不能说明反应Ⅰ达到平衡状态的是_________。
A.恒容密闭容器中混合气体的压强不再变化
B.恒容密团容器中混合气体的密度不再变化
C.混合气体的总物质的量不再变化
D.混合气体的平均相对分子质量不再变化
E.n(SO2)∶n(O2)∶n(SO3)=2∶1∶2
F.SO2气体的百分含量不再变化
(3)在保持体系总压为105Pa的条件下进行反应SO2+1/2O2![]() SO3,原料气中SO2和O2的物质的量之比m(m=
SO3,原料气中SO2和O2的物质的量之比m(m=![]() )不同时,SO2的平衡转化率与温度(t)的关系如下图所示:
)不同时,SO2的平衡转化率与温度(t)的关系如下图所示:
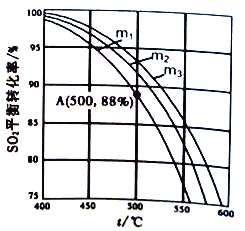
①图中m1、m2、m3的大小顺序为_________,理由是_________。
②反应I的化学平衡常数Kp表达式为_________(用平衡分压代替平衡浓度表示)。图中A点原料气的成分是:n(SO2)=10mol,n(O2)=24.4mol,n(N2)=70mol,达平衡时SO2的分压p(SO2)为_________Pa。(分压=总压×物质的量分数)。
③近年,有人研发出用氧气代替空气的新工艺,使SO2趋于全部转化。此工艺的优点除了能充分利用含硫的原料外,主要还有_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com