
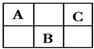
 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子的原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子的原子核内质子数和中子数相等.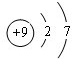 ,
,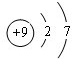 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、常温下二氧化硅不与任何酸反应,可用石英容器盛放氢氟酸 |
| B、常温下浓硝酸与铁不反应,可在常温下用铁罐贮运浓硝酸 |
| C、锌的金属活泼性比铁的强,可在铁船闸上装锌块减缓腐蚀 |
| D、氧化铝熔点很高,可用氧化铝制造坩埚融化氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀硝酸的溶液:K+、Cl-、HS-、SO32- |
| B、加入FeCl3溶液:I-、NH4+、Cl、Ba2+ |
| C、加入NaOH的溶液:Na+、AlO2-、CO32-、K+ |
| D、无色pH=12的溶液:Fe3+、Mg2+、Al3+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
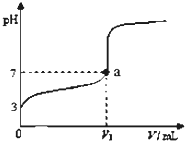 常温下,向20mL x mol?L-1 CH3COOH溶液中逐滴加入等物质的量浓度的
常温下,向20mL x mol?L-1 CH3COOH溶液中逐滴加入等物质的量浓度的| A、上述 CH3COOH溶液中:c(H+)=1×10-3mol?L-1 |
| B、图中V1>20mL |
| C、a点对应的溶液中:c(CH3COO-)=c(Na+) |
| D、加入NaOH溶液体积为20 mL时,溶液中:c(CH3COOH)+c(H+)=c(OH-)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
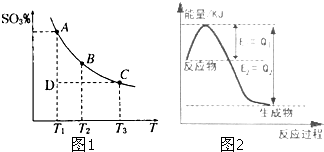 运用化学反应原理研究元素及其化合物的反应有重要意义.
运用化学反应原理研究元素及其化合物的反应有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+ Mg2+ Fe2+ Al3+ Fe3+ |
| 阴离子 | OH- Cl- CO32- NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 所用试剂 | |
| 实验操作及现象 | |
| 有关反应的化学方程式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com