
【题目】3,4-二羟基肉桂酸乙酯(I)具有抗炎作用和治疗自身免疫性疾病的潜力。由化合物A制备该物质的合成路线如下:
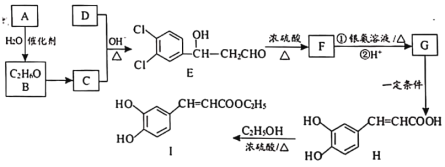
已知:R—CHO+R′—CH2—CHO![]()
![]()
回答下列问题:
(1)A的结构简式为___________。
(2)E生成F的反应类型为___________。
(3)下列有关H的说法中,不正确的是___________。
a.能使酸性高锰酸钾溶液褪色
b.1 mol H最多能和3 mol Br2反应
c.H分子中最多有9个碳原子共平面
d.l mol H分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为1:1
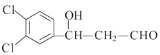
(4)写出C+D→E的化学方程式__________。
(5)已知W是H的同分异构体,符合下列条件的W结构共有________种。
①属于芳香族化合物。
②1 mol W与足量NaHCO3溶液反应生成气体44.8 L(标准状况)。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为:_________。
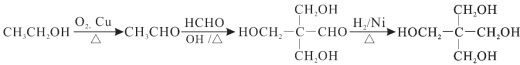
(6)季戊四醇(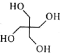 )是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A
)是合成高效润滑剂、增塑剂、表面活性剂等的原料。设计由甲醛和乙醇为原料制备季戊四醇的合成路线(无机试剂任选)___________。(合成路线的表示方法为:A![]() B……
B……![]() 目标产物)
目标产物)
【答案】CH2=CH2 消去反应 bd CH3CHO+![]()
![]()
 10
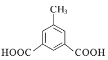
10 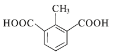 、
、
【解析】
由题中合成路线可知,A与水在催化剂的作用下生成C2H6O,则A为乙烯,B为乙醇;结合题中信息R—CHO+R′—CH2—CHO![]()
![]() 及E的结构可知,C为乙醛,D为
及E的结构可知,C为乙醛,D为![]() ;E发生消去反应生成F;F发生银镜反应后的产物经酸化转化为G;G在一定条件下发生取代反应生成H;H与乙醇发生酯化反应生成3,4-二羟基肉桂酸乙酯。
;E发生消去反应生成F;F发生银镜反应后的产物经酸化转化为G;G在一定条件下发生取代反应生成H;H与乙醇发生酯化反应生成3,4-二羟基肉桂酸乙酯。
(1)A为乙烯,其结构简式为CH2=CH2。
(2)醇在浓硫酸的作用下可以发生消去反应。结合E到H的各步反应的条件及H的结构,可以判断E生成F的反应类型为消去反应。
(3)a.H分子中有碳碳双键和酚羟基,故其能使酸性高锰酸钾溶液褪色,a说法正确;
b.H分子中苯环上的3个H原子可以被溴取代,碳碳双键可与溴发生加成反应,故1molH最多能和4molBr2反应,b说法不正确;
c.由苯分子的12原子共面及乙烯分子中6原子共面以及碳碳单键是可以旋转的可知,H分子中H最多有9个碳原子共平面,c说法正确;
d.H分子中的酚羟基和羧基都能与NaOH发生反应,但只有羧基可与NaHCO3反应,因此,lmolH分别与足量NaOH、NaHCO3反应时,消耗的NaOH、NaHCO3的物质的量之比为3:1,d说法不正确。
综上所述,说法不正确的有bd,故选bd。
(4)由题中信息R—CHO+R′—CH2—CHO![]()
![]() 可知,C+D→E的化学方程式为CH3CHO+
可知,C+D→E的化学方程式为CH3CHO+![]()
![]()
 。
。
(5)W是H(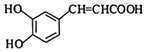 )的同分异构体,W结构的符合下列条件:
)的同分异构体,W结构的符合下列条件:
①属于芳香族化合物,则W分子中有苯环。
②1molW与足量NaHCO3溶液反应生成气体44.8L(标准状况),则W分子中有2个羧基。根据H的不饱和度及其所含有的碳原子数可知,若W的苯环上有3个取代基,即一个甲基和两个羧基,其在苯环上的排列方式有6种,若W的苯环上只有两个取代基,即-CH2COOH和-COOH,其在苯环的排列方式有3种;若W的苯环上只有一个取代基,则该取代基只能是-CH(COOH)2。综上所述,符合条件的W共有10种。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为 和
和 。
。
(6)由甲醛和乙醇为原料制备季戊四醇,根据题中信息,首先把乙醇催化氧化为乙醛,然后乙醛和甲醛发生信息中的反应生成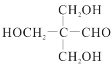 ,最后
,最后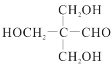 与氢气加成即可得到目标产品。具体合成路线如下:
与氢气加成即可得到目标产品。具体合成路线如下: 。
。


科目:高中化学 来源: 题型:
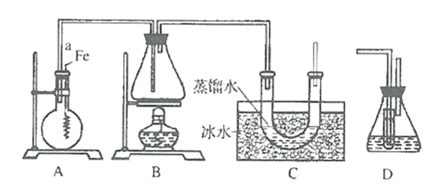
【题目】某实验小组用如图所示装置制取溴苯和溴乙烷.已知溴乙烷为无色液体,难溶于水,沸点为38.4℃,熔点为-190℃,密度为1.46gcm-3。
主要实验步骤如下:
①检查装置的气密性后,向圆底烧瓶中加入一定量的苯和液溴。
②向锥形瓶中加入乙醇和浓H2SO4的混合液至浸没进气导管口。
③将A装置中的纯铁丝小心向下插入混合液中。
④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10min。
请填写下列空白:
(1)写出A装置中制取溴苯的化学方程式__。
(2)导管a的作用是__。
(3)C装置中U型管内部用蒸馏水封住管底的作用是__。
(4)反应完毕后,U型管内液体分层,溴乙烷在__层(填:上或下)。
(5)步骤④中__(填“能”“否”)用大火加热,理由是__。
(6)为探究溴和苯的上述反应是取代反应而不是加成反应,用装置D代替装置B、C直接与A相连重新操作实验。
①装置D中小试管内装有CCl4,其主要作用是__。
②锥形瓶中装有水,反应后向锥形瓶的水溶液中滴加硝酸银溶液,若有__产生,证明该反应为取代反应。
(7)要检验某溴乙烷中的溴元素,正确的实验方法是:向盛有适量溴乙烷的试管中__。
A.加入新制的氯水振荡,再加入少量CCl4振荡,观察下层是否变为橙红色
B.滴入硝酸银溶液,再加入稀硝酸使溶液呈酸性,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,冷却后加入硝酸银溶液,观察有无浅黄色沉淀生成
D.加入NaOH溶液共热,冷却后加入稀硝酸使溶液呈酸性,再滴入硝酸银溶液,观察是否有浅黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用索氏提取器,用石油醚做溶剂从花生仁中提取油脂,装置如图。石油醚的主要成分为戊烷和已烷的混合物,沸程为:30℃~60℃。下列说法错误的是
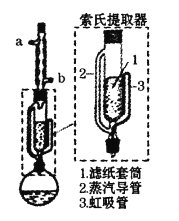
A.石油醚易挥发易燃烧,提取过程不可选用明火直接加热
B.石油醚的沸程较大,加热前不必加入沸石
C.烧瓶中的石油醚受热经侧管进入冷凝管,冷却后进入滤纸套筒与碎花生接触进行萃取
D.索氏提取器使用溶剂少,可循环连续萃取,萃取效率高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次减小的短周期主族元素,已知W、Y、Z的最外层电子数之和等于X的最外层电子数;由四种元素形成某化合物的结构如图所示。下列叙述不正确的是( )
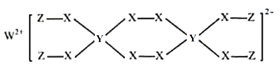
A.简单氢化物的稳定性:X>YB.简单离子半径:X>W
C.Y的最高价氧化物对应水化物为弱酸D.该化合物中各元素均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 和
和![]() 制备
制备![]() 的原理为:
的原理为:
①![]()
②![]()
已知:A、B均为有机物,两个反应均能自发进行;NA代表阿伏加德罗常数。下列说法正确的是
A.B为![]() 和
和![]() 制备
制备![]() 的催化剂
的催化剂
B.1mol![]() 与足量的B在一定条件下发生反应②,共转移2NA个电子
与足量的B在一定条件下发生反应②,共转移2NA个电子
C.反应①的反应物的总能量大于产物的总能量
D.标准状况下,22.4L![]() 含NA个分子
含NA个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图进行实验,探究H2O2的分解反应。
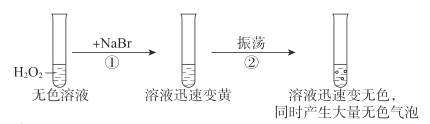
下列说法不正确的是( )
A.NaBr中的Br-加快了H2O2分解速率
B.双氧水既发生了氧化反应,又发生了还原反应
C.反应②的离子方程式是Br2+H2O2=2Br-+2H++O2↑
D.1molH2O2发生分解反应时,转移电子的物质的量是2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学研究金属锌与氯化铜溶液之间反应,在实验中该同学观察到的现象有:
i.产生少量气泡;ii.有红色固体生成;iii.溶液中产生白色沉淀。
为了解释上述现象,某同学查阅资料,获得如下信息:
编号 | 化学反应离子方程式 |
1 | Zn+Cu2+ |
2 | Zn+2Cu2+ |
3 | Cu++2Cl- |
4 | Cu++Cl- |
(1)请结合离子方程式解释产生少量气泡的原因:___。
(2)Zn与CuCl2反应生成白色沉淀的离子方程式是___。
(3)为了探究影响生成白色沉淀的因素,该同学进一步实验。取不同浓度CuCl2溶液,加入锌并振荡,均立刻产生少量气泡和红色固体,其他实验现象如下。
| 编号 | 浓度(rnol/L) | 试剂(锌均过量) | 实验现象 |
a | 0.5 | 锌片 | 立刻出现少量白色沉淀 | |
b | 1 | 锌片 | 立刻出现白色沉淀 | |
1 | 锌粉 | 立刻出现大量白色沉淀 | ||
d | 1 | 锌片、适量NaCl固体 | 少量白色沉淀,振荡迅速溶解 |
①对比实验a、b,实验结论是___。
②某同学从化学平衡的角度分析,d中白色沉淀溶解可能的原因是___(用离子方程式表示)。为证明该同学分析的原因正确,向b试管中加入适量___,振荡,观察到___,证明该同学分析的原因正确。
(4)利用沉淀法除去杂质在实际生产中应用广泛。
①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入___和___,生成沉淀而除去。
②通过进一步查阅资料得知:CuCl的形成与溶液的pH及Cu2+等离子浓度有关,一定条件下,通过实验得出pH、Cu2+浓度对Cl-沉淀的影响如图所示:
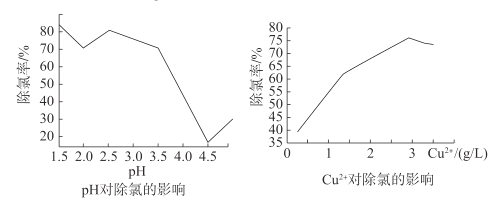
根据图,除去该电解液中Cl-的最佳条件是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用含砷氧化铜矿[含CuO、Cu2(OH)2CO3、As2O3及重金属盐等]制取![]() 的工艺流程如下:
的工艺流程如下:
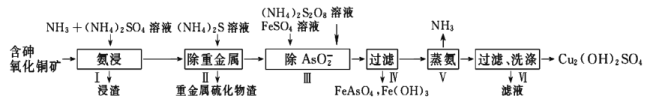
(1)过程中可循环利用物质的电子式是_________________。
(2)步骤I“氨浸”时,控制温度为5055℃,pH约为9.5,含铜化合物转化为![]() 溶液。
溶液。
①CuO被浸取的离子方程式为_________________。
②浸取温度不宜超过55℃,其原因是_________________。
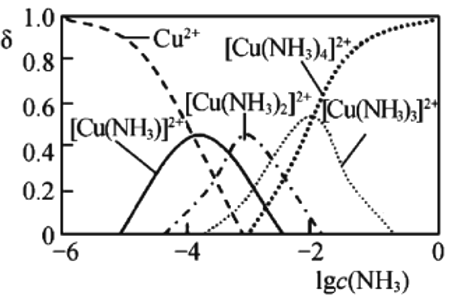
③Cu2+与NH3结合时,溶液中含铜微粒的物质的量分布分数(![]() )与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol
)与溶液中游离的c(NH3)的对数值的关系如图所示。若用1L浸取液(由等物质的量NH3和NH4+组成)将amol![]() 全部浸出为
全部浸出为![]() (
(![]() 转变为
转变为![]() ,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
,不考虑其他反应,溶液体积变化忽略不计),原浸取液中起始时c(NH3)应满足的条件是_________________。
(3)“除![]() ”时,加入的试剂是
”时,加入的试剂是![]() 和
和![]() 。
。
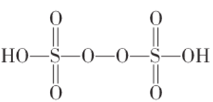
①已知![]() 结构式如图,根据此结构确定
结构式如图,根据此结构确定![]() 中S元素的化合价为_________________。
中S元素的化合价为_________________。
②![]() 需过量,一方面使
需过量,一方面使![]() 沉淀完全,另一目的是_________________。
沉淀完全,另一目的是_________________。
(4)“蒸氨”时发生反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下二种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+3H2(g) ΔH1=+205.9kJ·mol-1①
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
CO2(g)+H2(g) ΔH2=-41.2kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH3③
2CO(g)+2H2(g) ΔH3③
则反应①自发进行的条件是___,ΔH3=___kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com