
 .(若存在配位键需标出)
.(若存在配位键需标出)
分析 (1)①P原子核外有1s、2s、2p、3s、3p五种能级,一种能级有一种能量的电子;电子占据的最高能层符号为M;
②根据反应条件和反应物、生成物书写方程式;
③分子晶体熔沸点较低;
(2)①酸的酸性越强,该酸溶液的pKa越小;
②等电子体的结构和键合形式相同;
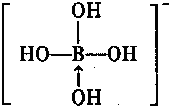
③硼酸电离方程式为B(OH)3+H20?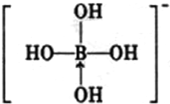 +H+,据此书写其电离出阴离子结构式;
+H+,据此书写其电离出阴离子结构式;
(4)孤电子对与成键电子对间的排斥力大于成键电子对之间的排斥力;
(5)根据图知,该晶胞是面心立方最密堆积,若该晶体中最邻近的两个P原子之间的距离为a nm,晶胞的棱长=$\sqrt{2}$anm,该晶胞中P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,B原子个数为4,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:(1)①P原子核外有1s、2s、2p、3s、3p五种能级,一种能级有一种能量的电子;电子占据的最高能层符号为M,故答案为:5;M;
②根据反应条件和反应物、生成物书写方程式为BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$ BP+6HBr,故答案为:BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$ BP+6HBr;
③分子晶体熔沸点较低,常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该晶体熔沸点较低,说明为分子晶体,故答案为:分子;
(2)①酸的酸性越强,该酸溶液的pKa越小,酸性:BrCH2COOH>CH3COOH,据此推测,酸性AtCH2COOH<ClCH2COOH,则pKa:AtCH2COOH>ClCH2COOH,故答案为:>;
②等电子体的结构和键合形式相同,则与磷酸根离子互为等电子体的微粒为SO42-、ClO4-等合理答案,故答案为:SO42-、ClO4-等合理答案;
③硼酸电离方程式为B(OH)3+H20? +H+,据此书写其电离出阴离子结构式为
+H+,据此书写其电离出阴离子结构式为 ,故答案为:
,故答案为: ;
;
(4)N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N-Si-N的键角为109.5°,而一个N原子与3个Si原子成键,N上还有一对孤对电子,孤电子对与成键电子对间的排斥力大于成键电子对之间的排斥力,所以Si-N-Si的键角更小,
故答案为:N、Si原子均采取sp3杂化,一个Si原子与4个N原子成键,N-Si-N的键角为109.5°,而一个N原子与3个Si原子成键,N上还有一对孤对电子,孤电子对与成键电子对间的排斥力大于成键电子对之间的排斥力,所以Si-N-Si的键角更小;
(5)根据图知,该晶胞是面心立方最密堆积,若该晶体中最邻近的两个P原子之间的距离为a nm,晶胞的棱长=$\sqrt{2}$anm,该晶胞中P原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,B原子个数为4,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{11+31}{{N}_{A}}×4}{(\sqrt{2}a×1{0}^{-7})^{3}}$=$\frac{(11+31)×4}{(\sqrt{2}a×1{0}^{-7})^{3}{N}_{A}}$.
故答案为:面心立方最密;$\frac{(11+31)×4}{(\sqrt{2}a×1{0}^{-7})^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、键角、等电子体、晶体类型判断等知识点,明确基本原理、基本计算机物质空间结构是解本题关键,侧重考查学生分析判断及计算能力,题目难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温,NaHCO3溶解度比Na2CO3小,向饱和Na2CO3溶液中通入CO2产生沉淀 | |
| B. | 常温,SiO2与氢氟酸、NaOH溶液均可反应,SiO2是两性氧化物 | |
| C. | BaSO3难溶于水,SO2气体通入Ba(NO3)2溶液中产生沉淀 | |
| D. | 非金属性:Cl>S,酸性:HClO>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中所有碳原子可能共平面 | |
| B. | 既能发生酯化反应又能发生氧化反应 | |
| C. | 1 mol该物质与H2完全加成,需消耗3 mol H2 | |
| D. | 比该物质少一个O原子,属于芳香族化合物的同分异构体有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
CO(g)+3H2(g)△H=-(a+b-3C)kJ.mol-1.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL1mol/LNa2CO3溶液中含有0.1NA个CO32- | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g | |
| C. | 1molCl2与过量Fe反应,转移的电子数为2 NA | |
| D. | 标准状况下,11.2L乙醇完全燃烧产生二氧化碳分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次增大 | |
| D. | 第ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ③④⑤⑥ | C. | ②④⑤⑥ | D. | ①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com