
| A. | 将lL2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| B. | 1L0.1mol/LNaHSO4溶液中含有0.1 Na个HSO4- | |
| C. | 常温常压下,23gNO2和N2O4的混合气体一定含有NA个氧原子 | |
| D. | lmol铁与足量稀盐酸反应转移的电子数目为3NA |
分析 A.一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B.NaHSO4溶液中无HSO4-;
C.NO2和N2O4中N和O原子比值都为1:2,则23g NO2和N2O4的混合气体中,含有的O原子质量为23g×$\frac{2×16}{1×16+14}$=16g,结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算.
D.铁和稀盐酸反应生成氯化亚铁和氢气.
解答 解:A.一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于2NA个,故A错误;
B.NaHSO4在溶液中完全电离为钠离子、氢离子和硫酸根,故溶液中无HSO4-,故B错误;
C.NO2和N2O4中N和O原子比值都为1:2,则23g NO2和N2O4的混合气体中,含有的O原子质量为23g×$\frac{2×16}{1×16+14}$=16g,则n(O)=$\frac{16g}{16g/mol}$=mol,则23gNO2和N2O4的混合气体氧原子数是1mol,NA个氧原子,故C正确;
D.反应后铁变为+2价,故1mol铁转移2mol电子即2NA个,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
 ②
②查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H2含碳量最高,燃烧生成的CO2最多 | |
| B. | C2H2燃烧时火焰最明亮 | |
| C. | CH4含氢量最高,燃烧生成H2O最多 | |
| D. | CH4、C2H4燃烧生成H2O质量不同,消耗O2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
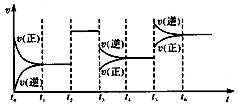 某密闭容器中发生反应:X(g)+3Y(g)?2Z(g)△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )
某密闭容器中发生反应:X(g)+3Y(g)?2Z(g)△H<0.如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中正确的是( )| A. | t2时加入了催化剂 | |
| B. | t3时平衡的移动可使化学平衡常数减小 | |
| C. | t5时增大了压强 | |
| D. | t6时达到平衡后反应物的转化率最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)5Cl]Cl2•H2O | ||
| C. | [Cr(H2O)4Cl2]Cl•2H2O | D. | [Cr(H2O)3Cl3]•3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
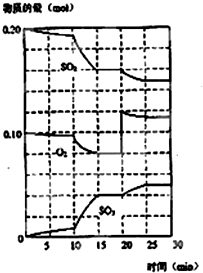 在一定条件下,二氧化硫和氧气发生如图反应:
在一定条件下,二氧化硫和氧气发生如图反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实 验 事 实 | 结 论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证明SO2有漂白性 |
| ② | 浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶不能保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,滴加稀盐酸,沉淀不溶解 | 证明Na2SO3已氧化变质 |
| ④ | 某溶液只含一种溶质,加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,向该溶液中滴加BaCl2溶液,有白色沉淀生成 | 确定该溶液中存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红 | 该溶液一定有NH4+ |
| A. | ①②④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com