
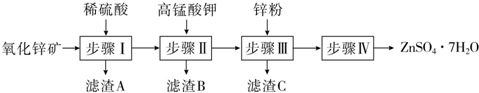
分析 氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,反应生成硅酸不溶,过滤分离,滤液中加入高锰酸钾溶液与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体.
(1)ZnSiO3与硫酸反应生成硅酸不溶,过滤分离;
(2)不断通入高温水蒸气可使反应液的温度升高,使反应物充分混合,以加快反应速率;
(3)在pH约为5.1的滤液中加入高锰酸钾,亚铁离子被氧化,生成Fe(OH)3和MnO(OH)2两种沉淀,配平书写离子方程式;
(4)步骤Ⅲ加锌粉置换铜离子,过滤得到硫酸锌溶液;
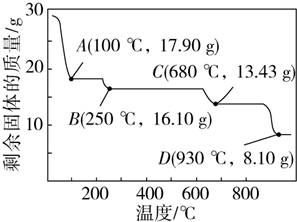
(5)ZnSO4•7H2O在温度较高时易失去结晶水;
(6)28.70 g ZnSO4•7H2O的物质的量为0.1mol,分别计算分解生成ZnO、ZnSO4、ZnSO4•H2O的质量,结合温度进行判断.
解答 解:氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)加稀硫酸溶解,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,反应生成硅酸不溶,过滤分离,滤液中加入高锰酸钾溶液与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,过滤,滤液中含有硫酸铜和硫酸锌,加锌粉置换铜离子,过滤,滤渣为Cu可能含有Zn,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4•7H2O晶体.
(1)步骤Ⅰ加入硫酸,加稀硫酸充分浸泡,过滤,滤液中含有硫酸锌、硫酸铜、硫酸亚铁,ZnSiO3与硫酸反应生成硅酸不溶,过滤分离,得到滤渣A为H2SiO3,
故答案为:酸浸和过滤;H2SiO3;
(2)步骤Ⅰ加入稀硫酸进行触浸时,需不断通入高温水蒸气,可增大反应的温度,使反应物充分混合,加快反应速率,
故答案为:升高温度,使反应物充分混合,以加快反应速率;
(3)在PH约为5.1的滤液中加入高锰酸钾,与亚铁离子反应生成MnO(OH)2和氢氧化铁沉淀,该反应的离子方程式为:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+,
故答案为:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+;
(4)步骤Ⅲ加锌粉置换铜离子,过滤得到硫酸锌溶液,滤液中含有Zn2+,
故答案为:Zn2+;
(5)ZnSO4•7H2O在温度较高时易失去结晶水,需在减压低温条件下干燥,
故答案为:降低烘干的温度,防止ZnSO4•7H2O分解;
(6)28.70 g ZnSO4•7H2O的物质的量为0.1mol,若得ZnSO4•H2O的质量为17.90g,则温度为100℃;若得ZnSO4的质量为16.10g,则温度为250℃;若得ZnO的质量为8.10g,则温度为930℃,据此通过排除法确定680℃时所得固体的化学式为Zn3O(SO4)2;
故答案为:b.
点评 本题以ZnSO4•7H2O的制备为载体,考查了基本实验操作、氧化还原反应、化学反应速率的影响因素、陌生方程式的书写、化学计算等知识,(6)中注意利用特殊值进行解答,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 时间/min SO3/mg 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的气态氢化物与其最高价氧化物的水化物之间能相互反应 | |
| B. | N单质能将K从其钠盐的水溶液中置换出来 | |
| C. | N的氢化物沸点高于其它同族元素氢化物的沸点 | |
| D. | P、Q、K对应的最高价氧化物的水化物相互之间可能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
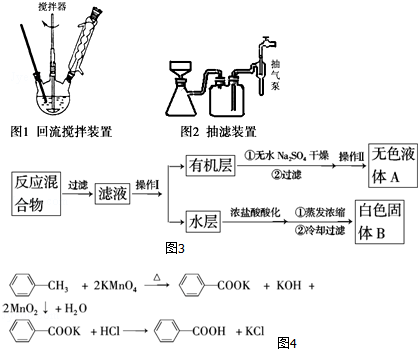
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究Na与水的反应可能有O2生成 | |
| B. | 探究SO2和Na2O2反应可能有Na2SO4生成 | |
| C. | 探究足量的铜与一定量的浓硝酸反应的气体产物是NO还是NO2 | |
| D. | 探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
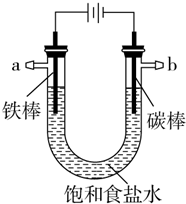 以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )
以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )| A. | 阳极电极反应式:Fe-3e-═Fe3+ | |
| B. | 水被电解后析出白色浑浊物为NaCl晶体 | |
| C. | 灰绿色浑浊是Fe(OH)2 | |
| D. | 随着电解的进行,溶液逐渐由中性变成碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
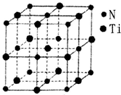 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题: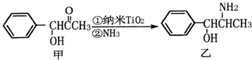
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
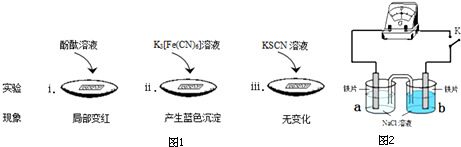
| 实验 | a | b | 指针偏转方向 |
| Ⅰ | 0.1% | 0.01% | 向右 |
| Ⅱ | 0.1% | 3.5% | 向左 |
| Ⅲ | 3.5% | 饱和溶液 | 向右 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的热稳定性逐渐增强 | |
| B. | A、B、C、D只能形成5种单质 | |
| C. | A、B的氧化物的水化物的酸性逐渐增强 | |
| D. | 由B、C、D三种元素组成的化合物中只能形成共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com