
| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA |
分析 A.二氧化硫与氧气反应生成三氧化硫的反应为可逆反应,反应物只能部分转化成生成物;
B.根据电子守恒进行计算,0.1mol铁完全反应生成四氧化三铁,失去了$\frac{8}{3}$mol电子,生成1mol氢气需要得到2mol电子,据此计算出生成氢气的物质的量;
C.混合液为中性,则氢离子与氢氧根离子浓度相等,结合电荷守恒可知钠离子与醋酸根离子浓度相等;
D.氮气和氨气分子中都含有3对共用电子对,0.1mol混合物中含有0.3mol共用电子对.
解答 解:A.2mol SO2和1mol O2混合在闭容器中加热反应后,由于该反应为体积减小的可逆反应,反应生成的三氧化硫的物质的量小于2mol,反应后气体的物质的量大于2mol,分子数大于2NA,故A正确;
B.0.1mol铁与足量水蒸气完全反应失去了$\frac{8}{3}$mol电子,根据电子守恒,生成了$\frac{8}{3}×\frac{1}{2}$=$\frac{4}{3}$mol氢气,生成的H2分子数为$\frac{4}{3}$NA,故B错误;
C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,氢离子和氢氧根离子浓度相等,根据电荷守恒可知钠离子和醋酸根离子的浓度也相等,则CH3COO-数目与钠离子数目相等,都是NA个,故C正确;
D.分子数为0.1NA的N2和NH3混合气体,由于氮气和氨气分子中都含有3对共用电子对,则混合物分子间含有的共用电子对数目为0.3NA,故D正确;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确铁与水蒸气反应生成的是四氧化三铁,为易错点.


科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 分析 |
| A | 发电厂将燃煤产生的废气通入高温下的石灰石 | 主要目的是生产CaSO4并得到副产品CO2 |
| B | ClO2代替Cl2对饮用水消毒 | ClO2消毒杀毒效率高,二次污染小 |
| C | 苏打、苛性钠可用于治疗胃酸过多 | 苏打、苛性钠都与胃酸反应 |
| D | 用环保绿色融雪除冰剂代替氯化钙、氯化钠融雪除冰 | 氯化钙、氯化钠会造成环境污染,但不会加速桥梁等设备腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中由水电离的氢离子浓度为10-4 | |
| B. | 与pH=4的盐酸等体积混合后,c(Cl-)>c(NH4+) | |
| C. | 通入一定量氨气后,依然存在c(NH4+)+c(H+)=c(OH-) | |
| D. | 氨水中存在:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO42- | |
| D. | 先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者不可能是同系物 | |
| B. | 二者一定是同分异构体 | |
| C. | 各1mol的A和B分别燃烧生成CO2的质量一定相等 | |
| D. | 二者最简式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
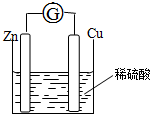 将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计,装置如图:
将锌片和铜片用导线相连浸入稀硫酸中组成原电池,两电极间连接一个电流计,装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素原子最外层电子数越少,该金属失电子能力越强 | |
| B. | 若存在简单阴离子R2-,则R一定位于ⅥA族 | |
| C. | aA2+、bB+、cC3-三种离子具有相同的电子层结构,则原子序数c>a>b | |
| D. | 铅位于周期表中金属和非金属的交界处,可作半导体材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com