
| A. | pH=10的NaOH溶液和pH=4的醋溶液等体积混合后溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$<1 | |
| B. | 向Ba(OH)2和氨水的混合溶液中滴加盐酸时$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$减小 | |
| C. | Na2CO3溶液中通入CO2,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$保持不变 | |
| D. | HClO溶液稀释为原来体积的100倍,$\frac{c(Cl{O}^{-})}{c(HClO)}$增大 |
分析 A、pH=10的NaOH溶液和pH=4的醋溶液等体积混合后溶液显酸性,据电荷守恒分析;
B、溶液碱性越强,对弱电解质一水合氨的电离的抑制程度越大;
C、$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$是碳酸根离子的水解平衡常数;
D、次氯酸是弱电解质,加水稀释时其电离程度增大.
解答 解:A、pH=10的NaOH溶液和pH=4的醋溶液等体积混合后溶液显酸性,溶液中只有4种离子,氢离子浓度大于氢氧根离子,据电荷守恒醋酸根离子浓度大于钠离子浓度,所以$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$>1,故A错误;
B、向碱性溶液中加入盐酸,溶液碱性减弱,一水合氨的电离程度增大,$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$减小,故B正确;
C、水解平衡常数只受温度影响,温度不变其数值不变,所以Na2CO3溶液中通入CO2,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$保持不变,故C正确;
D、加水稀释醋酸电离程度增大,次氯酸分子浓度减小程度大于次氯酸根离子浓度的减小程度,所以$\frac{c(Cl{O}^{-})}{c(HClO)}$增大,故D正确;
故选A.
点评 本题考查了影响弱电解质的电离平衡移动的因素以及水解平衡常数的影响因素,题目难度不大,注意弱电解质的电离平衡常数、盐类水解平衡常数都只受温度影响.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水保存在棕色试剂瓶中 | |
| B. | 少量的Na保存在煤油中 | |
| C. | NaOH溶液保存在带橡皮塞的试剂瓶中 | |
| D. | 氢氟酸保存在玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
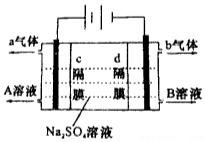 双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是( )
双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气.对该装置及其原理判断正确的是( )| A. | a气体为氢气,b气体为氧气 | |
| B. | A溶液为NaOH,B为H2SO4 | |
| C. | c隔膜为阳离子交换膜、d隔膜为阴离子交换膜 | |
| D. | 该电解反应的总方程式可以表示为:2Na2SO4+6H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+4NaOH+O2↑+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
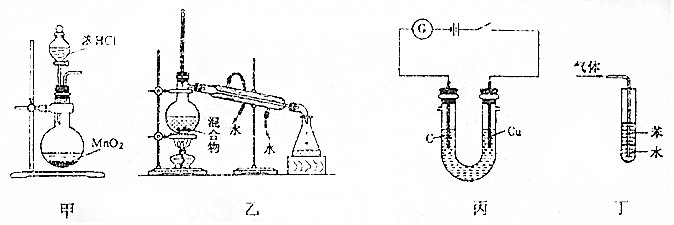
| A. | 利用装置甲制取氯气 | |
| B. | 利用装置乙分离乙酸(沸点:118℃)与乙酸乙酯(沸点:77.1℃) | |
| C. | 利用装置丙可电解食盐水制氯气和氢气 | |
| D. | 利用装置丁吸收NH3,并防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  向100mL 0.1mol•L-1H2SO4溶液中滴加0.1mol•L-1Ba(OH)2溶液至过量 | |
| B. | 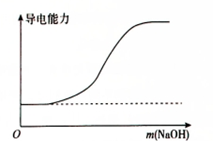 向100mL 0.1mol•L-1H2SO4溶液中加入NaOH固体 | |
| C. |  向一定浓度的氯化钠溶液中加水 | |
| D. |  向蒸馏水中通入HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 NaClO2溶液中可能存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒.用稀H2SO4或NaOH溶液调整溶液pH,经测定,25℃时各组分含量随pH的变化情况如图所示(Cl-没有画出).则该温度下,下列分析不正确的是( )
NaClO2溶液中可能存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒.用稀H2SO4或NaOH溶液调整溶液pH,经测定,25℃时各组分含量随pH的变化情况如图所示(Cl-没有画出).则该温度下,下列分析不正确的是( )| A. | NaClO2溶液呈碱性 | |
| B. | HClO2的电离平衡常数Ka=1.0×10-6 | |
| C. | pH=8的NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) | |
| D. | pH=5时含氯元素的微粒浓度大小关系:c(HClO2)>c(ClO2-)>c(Cl-)>c(ClO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子式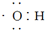 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| B. | 比例模型  可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作饮用水杀菌 | |
| D. | 原子结构示意图 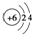 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
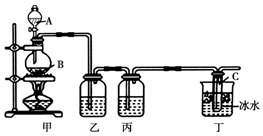 某化学活动小组欲用如图所示装置进行实验制取漂白液(次氯酸钠和氯化钠的混合溶液),并提高次氯酸钠含量.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2和NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3)试回答:
某化学活动小组欲用如图所示装置进行实验制取漂白液(次氯酸钠和氯化钠的混合溶液),并提高次氯酸钠含量.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2和NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3)试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com