
| m |
| M |
| 溶质质量 |
| 溶液质量 |
| 1000ρω |
| M |
| 560L |
| 22.4L/mol |
| 425g |
| 1425g |
| 1000×0.9×29.8% |
| 17 |


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
| A、增加A的物质的量,正反应速率一定增大 |
| B、升高温度正逆反应速率均增大 |
| C、保持容器体积不变充入稀有气体,若反应速率不变说明A是气体,C为非气体 |
| D、若改变条件使正反应速率减小,则逆反应速率也一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3、16、20 |
| B、2、4、18 |
| C、11、15、18 |
| D、9、10、17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 0 | 1 | 2 | 3 | 4 | 3 |
| n(SO2)/mol | 0.20 | 0.1 6 | 0.13 | 0.11 | 0.08 | 0.08 |
| A、当v(SO2)=v(SO3)时,说明该反应已达到平衡状态 |
| B、平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大 |
| C、若升高温度,则SO2的反应速率会变大,平衡常数K值会增大 |
| D、用O2表示0~4min内该反应的平均速率为0.005mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样3.52克置于铂舟并放入燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重1.44克和5.28克,生成物完全被吸收.试回答以下问题:
某同学为测定维生素C中碳、氢的质量分数,取维生素C样品研碎,称取该试样3.52克置于铂舟并放入燃烧管中,不断通入氧气流.用酒精喷灯持续加热样品,将生成物先后通过无水硫酸铜和碱石灰,两者分别增重1.44克和5.28克,生成物完全被吸收.试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
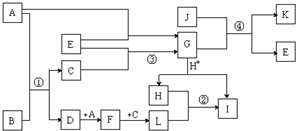 如图中各物质均为中学化学中的常见物质,其中A、E、J三种物质为单质,D的摩尔质量比F小16,F为红棕色气体;K是一种两性氧化物,可用KSCN检验I中的阳离子.它们的相互转化关系如图所示(图中部分产物、反应条件未列出).
如图中各物质均为中学化学中的常见物质,其中A、E、J三种物质为单质,D的摩尔质量比F小16,F为红棕色气体;K是一种两性氧化物,可用KSCN检验I中的阳离子.它们的相互转化关系如图所示(图中部分产物、反应条件未列出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com