
| m |
| M |
| m |
| n |
| 3 |
| 3 |
| m |
| M |
| 1 |
| 5 |
| 1 |
| 4 |
| m |
| n |
| 15.6g |
| 0.2mol |


科目:高中化学 来源: 题型:
| A、饮用水可以用明矾、漂白粉来净化,两者的作用原理相同 |
| B、常温常压下,78gNa2O2固体中所含阴离子数一定为NA |
| C、NH4Cl、MgCl2均为离子化合物,均含有离子键和共价键 |
| D、实验室中浓硝酸保存在带橡胶塞的棕色细口试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
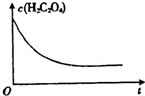 某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.
某合作小组同学在进行酸性高锰酸钾溶液与草酸(化学式为H2C2O4,被氧化为CO2)溶液的反应时,发现刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.该小组通过实验探究其原因.| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色所需时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 4 | ||
| 3 | 60 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
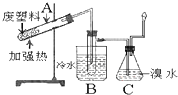 加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用.下列叙述不正确的是( )
加热聚丙烯废塑料可以得到碳、氢气、甲烷、乙烯、丙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用.下列叙述不正确的是( )| A、丙烯分子中共用电子对数为10 |
| B、装置B的试管中可收集到芳香烃 |
| C、装置C中的试剂可吸收烯烃以制取卤代烃 |
| D、最后收集的气体可做燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在食盐中添加适量的碘酸钾 |
| B、在食品加工中严格按照剂量标准科学使用食品添加剂 |
| C、研发高效低毒的农药,降低蔬菜的农药残留量 |
| D、用聚氯乙烯塑料袋包装食品 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com