
分析 (1)假设一:根据碳酸钠与硫酸铜符合复分解反应发生的条件,反应能生成碳酸铜沉淀,对所得固体进行猜想,写出反应的化学方程式;
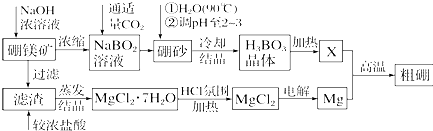
(2)②分析装置是利用测定溶解沉淀生成的二氧化碳质量计算得到,装置D是测定二氧化碳质量的干燥管,装置E中装有碱石灰,防止空气中的二氧化碳和水蒸气进入装置D,造成测定误差;
③空气中含有二氧化碳,空气通过氢氧化钠溶液吸收空气中的二氧化碳,利用除去二氧化碳的空气,打开K1、K3,关闭K2、K4,排除装置中的焓二氧化碳气体的空气,避免测定误差的产生;关闭K1、K3,打开K2、K4,装置B中样品充分反应,关闭K2,K3,打开K1、K4,再通入过量空气把装置中生成的二氧化碳气体全部赶到装置D中完全吸收,减少误差;
④若沉淀样品的质量为m g,若沉淀样品为纯净物,则判断沉淀为CuCO3,装置D的质量增加了n g,为二氧化碳气体质量,依据碳元素守恒得到mn的关系;若假设三正确,依据生成的二氧化碳物质的量减少碳酸铜质量,根据样品质量计算得到氢氧化铜的质量分数.
解答 解:(1)碳酸钠与硫酸铜通过交换成分可生成碳酸铜沉淀和硫酸钠,反应的化学方程式为:Na2CO3 +CuSO4═Na2SO4+CuCO3↓,
故答案为:Na2CO3 +CuSO4═Na2SO4+CuCO3↓;
(2)②装置是利用测定溶解沉淀生成的二氧化碳质量计算得到,装置D是测定二氧化碳质量的球形干燥管,装置E中装有碱石灰,防止空气中的二氧化碳和水蒸气进入装置D,造成测定误差,
故答案为:碱石灰;
③空气中含有二氧化碳,空气通过氢氧化钠溶液吸收空气中的二氧化碳,利用除去二氧化碳的空气,打开K1、K3,关闭K2、K4,排除装置中的焓二氧化碳气体的空气,避免测定误差的产生;关闭K1、K3,打开K2、K4,装置B中样品充分反应,关闭K2,K3,打开K1、K4,再通入过量空气把装置中生成的二氧化碳气体全部赶到装置D中完全吸收,减少误差;
故答案为:K1、K4;K2、K3;
④若沉淀样品的质量为m g,若沉淀样品为纯净物,则判断沉淀为CuCO3,装置D的质量增加了n g,为二氧化碳气体质量,依据碳元素守恒得到mg=$\frac{ng}{44g/mol}$×124g/mol,得到mn的关系为31n=11m;若假设三正确,依据生成的二氧化碳物质的量减少碳酸铜质量,根据样品质量计算得到氢氧化铜的质量分数=$\frac{mg-\frac{ng}{44g/mol}×124g/mol}{mg}$×100%=$\frac{m-\frac{31}{11}n}{m}$×100%,若不进行步骤C,生成的二氧化碳气体中含有水蒸气,被装置D吸收后称量得到二氧化碳质量增大,计算得到碳酸铜质量增大,氢氧化铜的质量减小,则会使测得结果质量分数偏低,
故答案为:$\frac{m-\frac{31}{11}n}{m}$×100%,偏低.
点评 本题考查了实验探究物质组成的实验设计和方案分析判断,装置特征分析,物质性质的分析应用是解题关键,实验基本操作和流程理解是解题关键,题目难度中等.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入澄清石灰水中 | B. | 稀硝酸中加入铜片 | ||
| C. | 稀硝酸中加入铁屑 | D. | HCl溶液滴入Na2CO3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
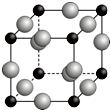 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L苯中含有的碳碳双键数目为1.5NA | |
| B. | 25℃时,1.0 L pH=12的Na2 CO3溶液中含有的阴离子数大于0.01NA | |
| C. | 标准状况下,2.8 g由N2和CO组成的混合气体中含有的原子数为0.1NA | |
| D. | 在反应:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,生成1 mol Cu,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com