分析:(1)物质导电有两种原因,一是金属类有自由移动的电子能够导电,二是能够电离产生自由离子能够导电;水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质;大多数的有机物都是非电解质,单质,混合物既不是电解质也不是非电解质;
(2)①根据电离方程式的书写要求书写;
②碳酸氢钠为强电解质,溶液中电离出钠离子和碳酸氢根离子;
③次氯酸钙粉末必须密封保存的原因是能与空气中的二氧化碳反应而变质;
④氯气与水反应,氯气自身的氧化还原反应,而且此反应是可逆的,生成HCl和HClO;
(3)①根据n=
计算物质的量,从而确定分子数目;
②根据n=
,结合物质的化学式来计算;
③根据n=
,M=
来计算.
解答:
解:①水银是金属单质,所以水银既不是电解质也不是非电解质,但能导电;
②CuSO
4?5H
2O本身无自由移动的离子,不导电,但溶于水或在熔融状态下能电离出自由移动的离子而导电,故为电解质;
③大理石即碳酸钙是盐,本身无自由移动的离子,不导电,但熔化状态下都能完全电离,CaCO
3═Ca
2++CO
32-有自由移动的离子,能导电,是电解质;
④氯化钠晶体本身无自由移动的离子,不导电,但溶于水或在熔融状态下能电离出自由移动的离子而导电,故为电解质;
⑤盐酸是HCl的水溶液,是混合物,虽然能导电,但既不是电解质也不是非电解质;
⑥NH
3是共价化合物,本身无自由移动的离子,在熔融状态下不导电,溶于水后不是NH
3本身电离出自由移动离子而导电,故为非电解质;
⑦蔗糖是以分子的形式分散在水中形成的溶液不能导电,不属于电解质,属非电解质;蔗糖固体以分子的形式存在不导电;
⑧Cl
2是单质,无自由移动离子,不导电,既不是电解质也不是非电解质;
⑨液态氯化氢是共价化合物,本身无自由移动的离子,故不导电;但HCl溶于水后能电离出自由移动的离子而导电,故为电解质;
⑩硫酸溶液是混合物,溶液中有自由移动的离子,能导电,但由于是混合物,故既不是电解质也不是非电解质.
故答案为:①⑤⑩;②③④⑨;⑥⑦;
(2)①Al
2(SO
4)
3属于盐,它的电离方程式为:Al
2(SO
4)
3=2Al
3++3SO
42-.故答案为:Al
2(SO
4)
3=2Al
3++3SO
42-.
②碳酸氢钠属于强电解质,溶液中完全电离,碳酸氢钠的电离方程式为:NaHCO
3═Na
++HCO
3-,
故答案为:NaHCO
3═Na
++HCO
3-.
③次氯酸钙粉末必须密封保存,是因为Ca(ClO)
2能与空气中的二氧化碳反应而变质,化学方程式为:Ca(ClO)
2+CO
2+H
2O═CaCO
3+2 HClO;故答案为:Ca(ClO)
2+CO
2+H
2O═CaCO
3+2 HClO;
④氯气自身的氧化还原反应,而且此反应是可逆的,则氯气和水反应的化学方程式为Cl
2+H
2O?HCl+HClO,HClO是弱酸,不能拆,故离子方程式为:
Cl
2+H
2O?H
++Cl
-+HClO,故答案为:Cl
2+H
2O?H
++Cl
-+HClO
(3)①设质量都为m,则氢气的物质的量为
mol,甲烷的物质的量为
mol,水的物质的量为
mol,
所以含分子数最多的是氢气,答案为:氢气;
②4.9g H
2SO
4的物质的量n=
=
=0.05mol,1molH
2SO
4中含7mol原子,故4.9g H
2SO
4中含有的原子数N=0.05mol×7×N
A/mol=0.35N
A,答案为:0.35N
A;
③a个X原子的物质的量n=
=
mol,则M=
=
=
NA,故答案为:
NA.



 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
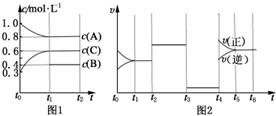 向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件.
向体积为2L的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)?3C(g)△H>0,各物质的浓度随时间变化的关系如图1所示,其中t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2,t3,t4各改变一种不同的条件. 由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题:
由周期表中前20号元素组成的单质X2、Y和化合物Z的有关信息如下表,X2、Y 和Z之间的转化关系如图(其他无关物质已略去).请回答下列问题: