
| 10.7-0.05×40-0.05×102 |
| 0.05 |
| 10.7-0.05×40-0.05×102 |
| 0.05 |


科目:高中化学 来源: 题型:
| A、-283.01KJ/mol |
| B、+172.51 KJ/mol |
| C、+283.01KJ/mol |
| D、-504.01 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
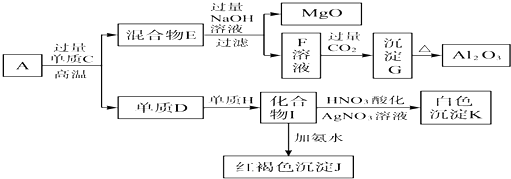
- 3 |
| A、CaO、MgO |
| B、CaCO3、MgCO3 |
| C、CaCO3、Mg(OH)2 |
| D、CaCO3、MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:
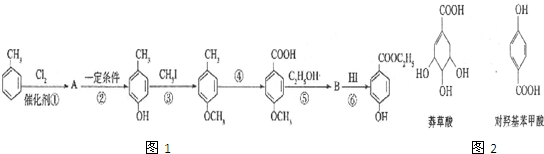
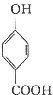 生成C7H5O3Na的化学反应方程式
生成C7H5O3Na的化学反应方程式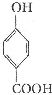 所有同分异构体的结构简式
所有同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B、乙醇(水):加入新制生石灰,蒸馏 |
| C、溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D、乙酸(乙醇):加入金属钠,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾能水解生成Al(OH)3胶体,可用作净水剂 |
| B、水解反应NH4++H2O?NH3?H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C、制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| D、盐类水解反应的逆反应是中和反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com