
| A. | 明矾净水 | B. | 工业固氮 | C. | 海水提镁 | D. | 电池充电 |
分析 反应中存在元素的化合价变化为氧化还原反应,若不存在元素的化合价变化,则不属于氧化还原反应,以此来解答.
解答 解:A.明矾水解生成具有吸附性的氢氧化铝胶体而达到净水的目的,与氧化还原反应无关,故A正确;
B.工业用氮气和氢气在催化作用下制备氨气,N、H元素化合价发生变化,属于氧化还原反应,故B错误;
C.海水中存在氯化镁,经提纯后,工业用电解氯化镁的方法冶炼镁,属于氧化还原反应,故C错误;
D.电池充电,电能转化为化学能,发生氧化还原反应,故D错误.
故选A.
点评 本题考查氧化还原反应,为高考高频考点,侧重于化学与生活、生产的考查,把握发生的化学反应及反应中元素的化合价变化为解答的关键,注意从化合价角度分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 有$\frac{1}{2}$NA个硫原子被还原 | B. | 有$\frac{1}{3}$NA个氮原子被氧化 | ||
| C. | 有$\frac{3}{4}$NA个二氧化硫分子生成 | D. | 有$\frac{2}{3}$NA个硫酸铵分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
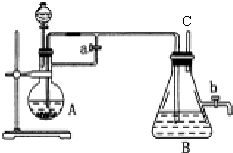
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
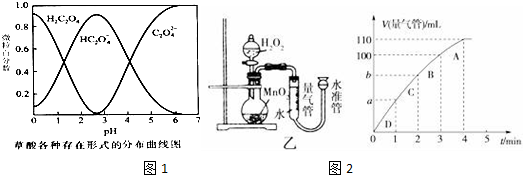
| 实验编号 | T/K | 催化剂的用量/g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.010 | a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③ 探究温度对反应速率的影响; c.实验①和④ 探究催化剂对反应速率的影响. |
| ② | ||||
| ③ | 0.010 | |||
| ④ |
| 实验编号 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| Ⅰ | 14.0 | 13.0 | 11.0 |
| Ⅱ | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
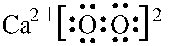 ;加热过氧化钙可分解生成CaO和O2,该反应的化学方程式为2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑.
;加热过氧化钙可分解生成CaO和O2,该反应的化学方程式为2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁钉在空气中出现红色的铁锈,其负极反应式为:Fe-3e-═Fe3+ | |
| B. | 氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+NH4+═Mg2++NH3•H2O | |
| C. | 向足量铝粉与氢氧化钠溶液反应后的溶液中滴加碳酸氢钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| D. | 漂白粉溶液中加氯化亚铁溶液产生大量沉淀:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | H+ Na+ Al3+ Ag+ Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L甲醛完全燃烧产生NA个CO2分子 | |
| B. | 1L1mol/L Na2CO3溶液中,阴离子个数等于NA | |
| C. | 100 g 98%的浓硫酸中含氧原子个数为4NA | |
| D. | 常温常压下,1mol白磷中含有共价键为4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com