
| A、碳酸钠固体 |
| B、把稀硫酸改为浓硫酸 |
| C、硫酸钾稀溶液 |
| D、铜粉 |


科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4 溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | Al箔插入稀HNO3中 | 开始无现象 | Al箔表面被HNO3氧化钝化,形成致密的氧化膜 |
| D | 向浓度均为0.1mol?L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| A、A、 | B、B、 | C、C、 | D、D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
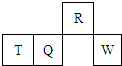 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A、原子半径一定是:T>Q>R |
| B、最高价氧化物对应水化物的酸性一定是:Q<W |
| C、含T的盐溶液一定显酸性 |
| D、最简单气态氢化物的热稳定性一定是:R>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③⑥ | C、②④ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极产物是氢气 |
| B、阳极产物是氧气 |
| C、阴极产物是铝和氧气 |
| D、阳极产物只有氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
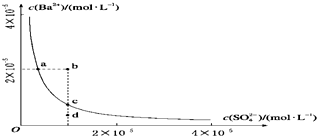
| A、加入Na2SO4可以使溶液由a点变到c点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、b、d点都是不能长时间稳定存在的点 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
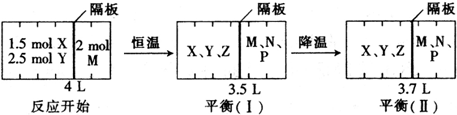
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com