
| A. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| B. | 向2.0×10-4 mol/L的K2CrO4溶液中加入等体积的2.0×10-4mol/AgNO3溶液后,则有Ag2CrO4沉淀生成 | |
| C. | 将一定量的AgCl和Ag2CrO4固体混合物溶于蒸馏水中,充分溶解后,静置,上层清液中的Cl的物质的量浓度最大 | |
| D. | 将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L的K2CrO4的混合溶液中,则先产生AgCl沉淀. |
分析 A、AgCl的Ksp只与温度有关,与离子的浓度有关;
B、计算溶液中的Q与Ksp(Ag2CrO4)=1.12×10-12 mol3•L-3比较;
C、AgCl和Ag2CrO4固体混合物溶于蒸馏水中,AgCl和Ag2CrO4都会产生银离子;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-、CrO42-开始沉淀时c(Ag+)各是多少.
解答 解:A、AgCl的Ksp只与温度有关,向AgCl的浊液中加入氯化钠溶液,虽然平衡向逆方向移动,但Ksp不变,故A错误;
B、Q=c2(Ag+)×c(CrO42-)=$(\frac{2.0×1{0}^{-4}}{2})^{2}×(\frac{2.0×1{0}^{-4}}{2})$=1.0×10-12<Ksp(Ag2CrO4)=1.12×10-12 mol3•L-3,所以没有沉淀生成,故B错误;
C、AgCl和Ag2CrO4固体混合物溶于蒸馏水中,AgCl和Ag2CrO4都会产生银离子,所以银离子浓度最大,故C错误;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=1.8×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=4.36×10-5 mol/L,故先产生AgCl沉淀,故D正确;
故选D.
点评 本题考查溶度积常数的有关计算、判断离子是否完全,沉淀等问题,综合性强,难度较大.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
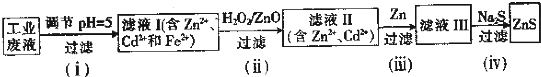
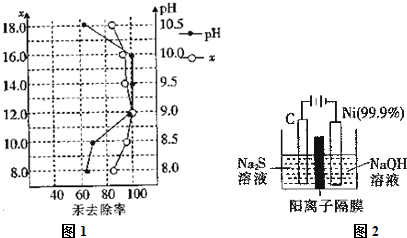
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
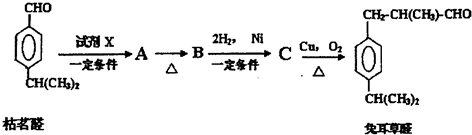
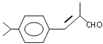 ;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液.
;检验B中的官能团时,需先加入的试剂是新制氢氧化铜悬浊液;酸化后,再加入的试剂是溴水或高锰酸钾溶液. .
.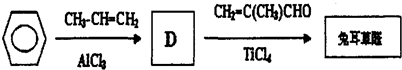
 .D→兔耳草醛的反应类型是加成反应.
.D→兔耳草醛的反应类型是加成反应. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g金刚石中含有碳酸键的个数为2NA | |
| C. | 25℃时1.0LpH=13的NaOH溶液中含有H+的数目为0.1NA | |
| D. | 1mol的甲基与1mol的铵银离子所含电子数均为10NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
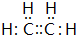 ,A的结构简式H2C=CH2.
,A的结构简式H2C=CH2. ,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.
,写出B的一种含三键且无支链的链烃的结构简式CH≡C-CH=CH-CH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强 | |
| B. | 某微粒的结构示意简图为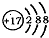 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | Be(OH)2的碱性比Mg(OH)2的碱性强 | |
| D. | 原子半径:Na>Si>O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸镁晶体分解反应是放热反应 | B. | 氯化镁水解是熵增反应 | ||
| C. | 硫酸镁晶体分解反应是熵减反应 | D. | 氯化镁分解放热比硫酸镁少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1NaClO溶液中含有的ClO-数目为NA | |
| B. | 常温常压下,11.2 L Cl2含氯原子数为NA | |
| C. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com