
下列关于胶体的性质及应用的叙述正确的是(双选)( )
A.明矾能水解生成Al(OH)3胶体,可用作净水剂
B.将饱和的FeCl3溶液加热煮沸的方法制取氢氧化铁胶体
C.葡萄糖溶液和淀粉溶液的本质区别是能否发生丁达尔效应
D.提纯胶体用的渗析原理与从悬浊液过滤获取沉淀的原理相似
科目:高中化学 来源: 题型:
下列有关电解质溶液中粒子浓度关系正确的是( )
A.pH=1的NaHSO4溶液:c(H+)=c(SO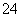 )+c(OH-)
)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
C.CO2的水溶液:c(H+)>c(HCO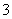 )=2c(CO
)=2c(CO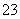 )
)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O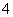 )+c(C2O
)+c(C2O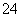 )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
一条件下,CH3COOH溶液中存在电离平衡:
CH3COOHCH3COO-+H+ ΔH>0
(1)下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是________。
a.加入少量0.10 mol·L-1稀盐酸 b.加热
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(2)25℃时,醋酸的电离平衡常数为1.75×10-5。现有:
①0.10 mol·L-1 CH3COOH溶液 ②0.001 mol·L-1 CH3COOH溶液
①和②中c(H+)之比为________。[提示:进行简化计算,平衡时c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计]
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列说法是否正确,正确的打“√”,错误的打“×”
(1)化合物既可分为酸、碱、盐、氧化物,又可分为电解质和非电解质( )
(2)非金属氧化物不一定是酸性氧化物,但酸性氧化物一定是非金属氧化物( )
(3)Al2O3可与盐酸和氢氧化钠反应,SiO2可与氢氟酸和氢氧化钠反应,因而二者均属于两性氧化物( )
(4)KHCO3的水溶溶呈碱性,是碱式盐;NaHSO4的水溶液呈酸性,是酸式盐( )
(5)Na2O2、SO2、CH3COOH等为共价化合物;H2SO4、NaOH、Na2CO3等为离子化合物( )
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的组成及分类正确的是( )
A.NH3的水溶液可以导电,说明NH3是电解质
B.明矾、冰水混合物、四氧化三铁都是纯净物
C.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质
D.SiO2、NO2、Al2O3都属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质变化的说法正确的是( )
A.熔融态的Al2O3导电、12C转化为14C都属于化学变化
B.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类
C.用热的纯碱溶液洗涤沾有油污的器具时涉及化学变化和物理变化
D.将盛有NO2气体的密封烧瓶,放入热水中气体颜色加深的变化是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是( )
A.过氧化钠的电子式:
B.质子数为35、中子数为45的溴原子: Br
Br
C.硫离子的结构示意图: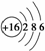
D.间二甲苯的结构简式: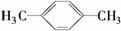
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中 正确的是(
正确的是( )
)
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,
又有CaCO3沉淀生成
B.向Na2 CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原溶液中Na2CO3的物质
的量之比为1:2
C.等质量的NaHCO3和Na2 CO3分别与足量稀盐酸反应,在同温同压下,生成的CO2体积相同
CO3分别与足量稀盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入足量CO2,有NaHCO3 结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室用锌片和稀硫酸反应制取氢气,并验证氢气的还原性及回收硫酸锌晶体。
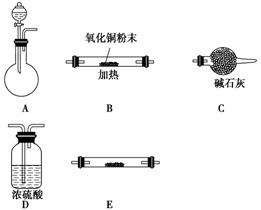
①各仪器的连接顺序为__________,装置E中盛放的试剂为__________,装置C的作用是________________________。
②锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从BaCl2溶液、Zn粉、NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程______________________________。
(2)工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。
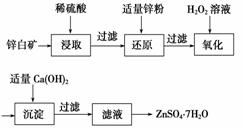
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为3.7、6.5、9.7。
①为了提高酸浸效率,可以采取的措施有__________________(写出两条即可)。
②加入适量锌粉的作用为________________。
③氧化过程中H2O2发生反应的离子方程式为______________________________。
④由滤液得到ZnSO4·7H2O的操作依次为__________、__________、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com