
电解原理在化学工业中有广泛应用.
(1)图1是电解食盐水的工业模拟图
①电解饱和食盐水的离子方程式
②溶液A是
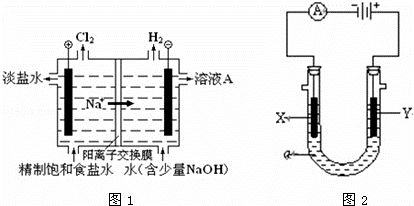
(2)图2是实验室常用的电解池装置,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①在X(填X或Y)极附近观察溶液变红.
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是把
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是 ,电极反应式是
考点:电解原理.
分析:(1)①用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,据此书写离子;
②用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠;
(2)①用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极X电极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,滴加酚酞,溶液变红;
②用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,氯气具有氧化性,可以用湿润的碘化钾淀粉试纸检验;
(3)电解方法精炼粗铜,电解液是含有铜离子的盐溶液,阴极的材料是纯铜,阳极材料是粗铜,据此回答.
解答: 解:(1)①用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,所以电池反应式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,电解饱和食盐水的离子方程式为:2Cl﹣+2H2O
2NaOH+H2↑+Cl2↑,电解饱和食盐水的离子方程式为:2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑,故答案为:2Cl﹣+2H2O
2OH﹣+H2↑+Cl2↑,故答案为:2Cl﹣+2H2O 2OH﹣+H2↑+Cl2↑;
2OH﹣+H2↑+Cl2↑;
②用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,即溶液A是氢氧化钠浓溶液;故答案为:氢氧化钠浓溶液;
(2)①用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,阴极X电极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,滴加酚酞,所以X极溶液变红,故答案为:X;
②用惰性电极电解饱和食盐水时,阳极上氯离子放电生成氯气,电极反应为:2Cl﹣﹣2e﹣=Cl2↑,氯气的检验方法:把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色,故答案为:2Cl﹣﹣2e﹣=Cl2↑;把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色;
(3)电解方法精炼粗铜,电解液是含有铜离子的盐溶液,如CuSO4溶液,则阴极的材料是纯铜,阳极材料是粗铜,在阴极区域发生反应:Cu2++2e﹣=Cu,故答案为:纯铜;Cu2++2e﹣=Cu.
点评:本题考查了电解原理、气体的检验等知识点,明确离子放电顺序是解本题关键,氯气可以用淀粉碘化钾检验,难度不大.


科目:高中化学 来源: 题型:
下列关于醛的说法中正确的是( )
A.所有醛中都含醛基和烃基
B.所有醛都会使溴水和酸性KMnO4溶液褪色,并能发生银镜反应
C.一元醛的分子式符合CnH2nO的通式
D.醛的官能团是—COH
查看答案和解析>>
科目:高中化学 来源: 题型:
2010年上海世博会主题是“城市,让生活更美好”,试回答下列问题:
(1)为确保世博会期间申城空气质量优良率达到95%以上,世博会期间的空气质量状况监测中,不需要监测的指标是 .
a.可吸入颗粒物(PM10)b.NO2浓度 c.SO2浓度 d.CO2浓度;
(2)为了改善空气质量,必须控制大气中二氧化硫、氮氧化物、烟尘等污染物的排放量.对汽车加装尾气催化净化装置,使其中的有害气体NO、CO转化为无害气体,该反应的化学方程式为 .
(3)为2010年世博会期间提供科学有效的环境质量保障方案,白龙港污水处理厂升级改造,处理废水时加入KAl(SO4)2•12H2O或碱式氯化铝的作用是 ;通入臭氧或二氧化氯的作用是消毒剂.某农村地区为获得饮用水,在将地表水取回家后,常使用漂白粉或漂白精片进行杀菌消毒,其原理可用化学方程式表示为 .
(4)近日,世博会中国馆﹣﹣“东方之冠”,它由钢筋混凝土、7000多块红色铝板和1200多块玻璃等建成.其中部分玻璃为石英玻璃,它化学稳定性强、膨胀系数小,是一种特种玻璃,石英玻璃的主要成分是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方法中可以说明2HI(g)⇌H2(g)+I2(g)已达到平衡的标志是( )
A.c(HI):c(H2):c(I2)=2:1:1时
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和体积一定时,混合气体的颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
结合图判断,下列叙述正确的是( )
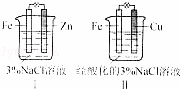
A.Ⅰ是验证牺牲阳极的阴极保护法的实验装置
B.Ⅰ和Ⅱ中负极反应均是Fe﹣2e﹣=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e﹣=4OH﹣
D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.标准状况下,22.4L己烷中含己烷分子数目为NA
B.28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA
C.71gNa2SO4固体中含钠离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| 沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)加入ZnO调节pH=a的目的是______________,a的范围是 。
(2)由不溶物E生成溶液D的化学方程式为____________________________。
(3)滤液A中加入H2O2反应的离子方程式为 。
(4)由溶液D制胆矾晶体包含的主要操作步骤是 。
(5)下列试剂可作为Y试剂的是______。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
A. n(Cl2):n(Fe)=5:4 5Cl2+4Fe  2FeCl2+2FeCl3
2FeCl2+2FeCl3
B. n(Cl2):n(FeBr2)=1:1 Fe2++2Br﹣+Cl2═Fe3++Br2+2Cl﹣
C. n(MnO4﹣):n(H2O2)=2:3 2MnO4﹣+3H2O2+6H+═2Mn2++4O2↑+6H2O
D. n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3﹣═3Fe2++Fe3++3NO↑+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com