
 .
. )不能与强碱性物质混合使用,其原因是
)不能与强碱性物质混合使用,其原因是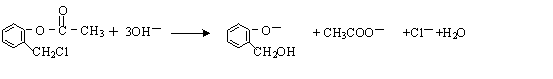 (写离子方程式).
(写离子方程式). )通过加成、取代等一系列转化合成某高分子化合物
)通过加成、取代等一系列转化合成某高分子化合物
 、
、 、
、 、
、 .
. 分析 (1)TNT是硝酸与苯酚在浓硫酸的作用下生成的;
(2) 中有酯基和氯原子,在强碱性条件下都能水解;
中有酯基和氯原子,在强碱性条件下都能水解;
(3)根据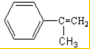 和C的结构及高聚物的分子式可知,
和C的结构及高聚物的分子式可知, 与溴水发生加成反应生成A为
与溴水发生加成反应生成A为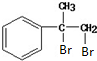 ,A在碱性条件下水解得B为
,A在碱性条件下水解得B为 ,B发生氧化反应得C,C进一步氧化得D为
,B发生氧化反应得C,C进一步氧化得D为 ,D在浓硫酸加热的条件下发生消去反应得E为
,D在浓硫酸加热的条件下发生消去反应得E为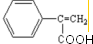 ,E与乙醇发生酯化反应生成F为
,E与乙醇发生酯化反应生成F为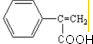 ,F发生加聚反应得高聚物为
,F发生加聚反应得高聚物为 ,据此答题;
,据此答题;
解答 解:(1)TNT是硝酸与苯酚在浓硫酸的作用下生成的,反应的方程式为 ,
,
故答案为: ;
;
(2) 中有酯基和氯原子,在强碱性条件下都能水解,所以不能与强碱性溶液混合使用,反应的方程式为
中有酯基和氯原子,在强碱性条件下都能水解,所以不能与强碱性溶液混合使用,反应的方程式为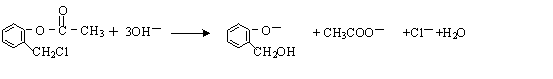 ,
,
故答案为: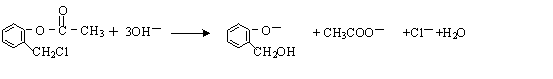 ;
;
(3)根据 和C的结构及高聚物的分子式可知,
和C的结构及高聚物的分子式可知, 与溴水发生加成反应生成A为
与溴水发生加成反应生成A为 ,A在碱性条件下水解得B为
,A在碱性条件下水解得B为 ,B发生氧化反应得C,C进一步氧化得D为
,B发生氧化反应得C,C进一步氧化得D为 ,D在浓硫酸加热的条件下发生消去反应得E为
,D在浓硫酸加热的条件下发生消去反应得E为 ,E与乙醇发生酯化反应生成F为
,E与乙醇发生酯化反应生成F为 ,F发生加聚反应得高聚物为
,F发生加聚反应得高聚物为 ,反应③的化学方程式分别为
,反应③的化学方程式分别为 ,反应⑤的化学方程式分别为
,反应⑤的化学方程式分别为 ,反应⑥的化学方程式分别为
,反应⑥的化学方程式分别为 ,反应⑦的化学方程式分别为
,反应⑦的化学方程式分别为 ,
,
故答案为: ;
; ;
; ;
; .
.
点评 本题考查了有机化学方程式的书写、有机推断及有机合成,题目难度中等,正确理解题干信息及合成原理为解答关键,注意掌握常见有机物结构与性质,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题

| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 90s | 5s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 |
| 褪色时间 | 100s | 90s |
| 实验现象 | 均有气泡产生;②号试管的溶液褪色比①号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | |
| 编号 | ①号试管 | ②号试管 | ③号试管 |
| 褪色时间 | 88s | 100s | 120s |
| 实验现象 | 均有气泡产生;①号试管的溶液褪色比②、③号试管的溶液快,它们颜色变化如下:紫红色→红色→橙红色→橙色→黄色→无色. | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在(t1+10)min时,其他条件不变,增大压强,平衡向逆反应方向移动 | |
| B. | (t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向右移动 | |
| C. | T℃时,在相同容器中,若由0.3 mol•L-1 A、0.1 mol•L-1 B和0.4 mol•L-1C反应,达到平衡后,C的浓度仍为0.4 mol•L-1 | |
| D. | 该反应为吸热反应,温度升高,平衡正向移动,A的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | |
| A | Na | H2O | Cl2 |
| B | Al | Fe2O3 | 稀H2SO4 |
| C | CH3CH2OH | NaOH溶液 | CH3COOH |
| D | Ba(OH)2溶液 | CO2 | Na2CO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同.
已知A、B、C、D、E五种元素均位于周期表的前四周期,且原子序数依次增大.元素A是周期表中原子半径最小的元素;B的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;D位于第2周期,其原子核外成对电子数是未成对电子数的3倍;E位于ds区,且原子的最外层电子数与A的相同.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L | B. | 1 mol/L | C. | 2 mol/L | D. | 4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | 只有②③④ | C. | 只有①③④ | D. | 只有②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向4 mL FeCl2溶液中滴加两滴浓硝酸:Fe2++2H++NO${\;}_{3}^{-}$═Fe3++NO2↑+H2O | |
| B. | 向石灰水中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO${\;}_{3}^{-}$═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| C. | 铝与稀硫酸反应:Al+2H+═Al3++H2↑ | |
| D. | 向NH4 Al(SO4)2加入少量的NaOH溶液:NH${\;}_{4}^{+}$+OH-═NH3.H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:20 | B. | 1:10 | C. | 20:1 | D. | 10:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com