
【题目】下列反应中,HNO3既表现酸性又表现出氧化性的是
A. 使紫色石蕊溶液变红 B. 与铜反应
C. 与Na2CO3溶液反应 D. 与S单质混合共热时生成H2SO4和NO2
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O=== [Zn(H2O)4]2++4HOCH2CN
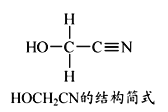
(1)Zn2+基态核外电子排布式为 ________。
(2)1 mol HCHO分子中含有σ键的数目为_______mol。
(3)HOCH2CN分子中碳原子轨道的杂化轨道类型是________。
(4)与H2O分子互为等电子体的阴离子为_____________。
(5)C、N、O第一电离能由小到大的顺序__________。
(6)[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:
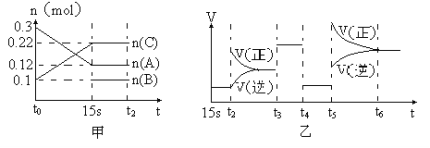
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为 。
(2)乙图中t2时引起平衡移动的条件是 ,t5时引起平衡移动的条件是 。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是 。
(4)该反应的化学方程式可以表示为: ,正反应为 (填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 水溶液中能电离出H+的化合物叫做酸
B. 实验测得2mol某气体体积为44.8L,则测定条件一定是标准状况
C. 摩尔是七个基本物理量之一
D. 化合物分为酸、碱、盐和氧化物是用树状分类法分类的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—有机化学基础】有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如下:
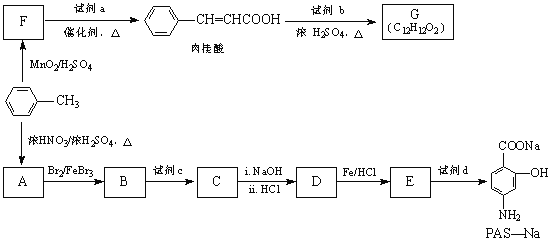
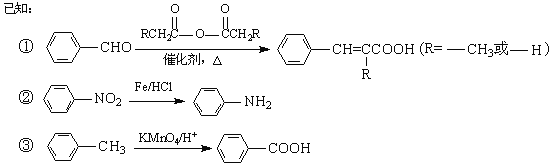
回答下列问题:
(1)![]() 生成A的反应类型是 。
生成A的反应类型是 。
(2)F中含氧官能团的名称是 ;试剂a的结构简式为 。
(3)写出由A生成B的化学方程式: 。
(4)质谱图显示试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,写出肉桂酸与试剂b生成G的化学方程式:。
(5)当试剂d过量时,可以选用的试剂d是 (填字母序号)。
a.NaHCO3 b.NaOH c.Na2CO3
(6)写出C与足量NaOH在一定条件反应的化学方程式 。(不用写条件)
(7)肉桂酸有多种同分异构体,符合下列条件的有 种。
a.苯环上有三个取代基;
b.能发生银镜反应,且1mol该有机物最多生成4molAg。
由上述符合条件的同分异构体中,写出苯环上有两种不同化学环境氢原子的有机物的结构简式 (任写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体的工艺流程如图所示:
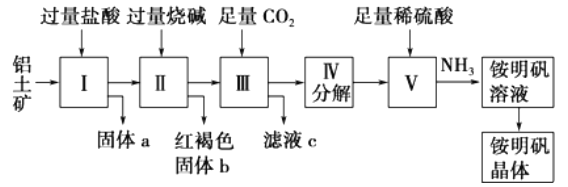
请回答下列问题:
(1)固体a的化学式为____,固体b化学式为____,Ⅲ中通入足量CO2气体发生反应的离子方程式为________________.
(2)由Ⅴ制取铵明矾溶液的化学方程式为______________.
(3)由I→II→III→IV都要用到的分离方法是______,由铵明矾溶液中制铵明矾晶体的操作是______________.
(4)如果先向铝土矿加入过量氢氧化钠,再加入过量盐酸,此时首先出现的固体a是__.
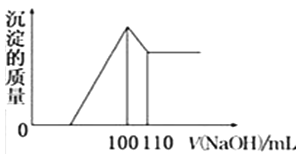
(5)向10gFe2O3、SiO2和Al2O3的混合物中,加入100ml稀硫酸,过滤后,向滤液中加入10mol/L NaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示.则混合物中三氧化二铝的质量分数为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气脱硝脱碳主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0。在一定条件下的密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
N2(g)+2CO2(g) △H<0。在一定条件下的密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
C(NO)/mol L-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-5 | 1.50×10-3 | 1.5×10-3 |
C(CO)/mol L-1 | 9.00×10-3 | 4.00×10-3 | 2. 00×10-3 | 1.00×10-3 | .1.00×10-3 |
下列说法正确的是
A. —定温度下,从开始到平衡,该反应的平衡常数逐渐增大
B. 前2s内的平均反应速率v(N2) = 1.75×10-3 mol·L-1·s-1
C. 达到平衡时,CO的转化率为11. 11%
D. 3s时NO和CO的浓度都不再变化,反应停止进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用氮化镓、铜等材料组装成人工光合系统(如下图),利用该装置成功地实现了以CO2和H2O合成CH4。
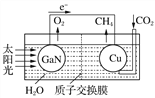
(1)写出铜电极表面的电极反应式:_______________________________________________________。
(2)为提高该人工光合系统的工作效率,可向装置中加入少量_________(选填“盐酸”或“硫酸”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com