
【题目】下列叙述正确的是( )
A. 氢氟酸贮存在细口玻璃瓶里
B. 盛溴的试剂瓶里加一些水来防止溴挥发
C. 可用滴加酚酞看其是否变红的方法来检测久置的烧碱是否变质
D. 氯水保存在无色玻璃瓶中;液氯存贮存在钢瓶里
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 只含离子键的化合物才是离子晶体
B. (NH4)2SO4晶体是含有离子键、极性共价键和配位键的晶体
C. 由于I—I中的共价键键能比F—F、Cl—Cl、Br—Br都弱,因此在卤素单质中I2的熔点、沸点最低
D. 液态氯化氢能导电,说明氯化氢不是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )

A. 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
B. pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-)
C. 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D. 若是0.1mol NaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。下列有关说法正确的是:

A. 根据上述步骤II可以得出m(Fe2O3)∶m(Cu)=1∶1
B. 步骤I中减少的3 g固体一定是混合物
C. 步骤II中质量减少的物质一定是Cu
D. 根据步骤I、II可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存或使用正确的是
A.实验室的氯水需要保存在棕色试剂瓶中
B.漂白粉比氯水稳定,可露置在空气中
C.称量氢氧化钠固体时,可在天平两个托盘上各放一张等质量的纸,左边纸上放NaOH,右边纸上放砝码
D.金属钠可保存在煤油、四氯化碳等有机溶剂中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4![]() 2ClO2+2NaHSO4,下列说法中正确的是
2ClO2+2NaHSO4,下列说法中正确的是
A. NaClO3在反应中失去电子
B. SO2在反应中被氧化
C. H2SO4在反应中作氧化剂
D. 1 mol氧化剂在反应中得到2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,能长时间保持稳定的放电电压。其电池总反应为:3Zn + 2K2FeO4 + 8H2O![]() 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
A. 放电时负极反应为:Zn-2e-+2OH-= Zn(OH)2
B. 充电时阳极发生氧化反应,附近溶液碱性增强
C. 充电时每转移3mol电子,阴极有1.5molZn生成
D. 放电时正极反应为:FeO42- + 3e- + 4H2O = Fe(OH)3 + 5OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证氯气的氧化性,将氯气分别通入①KI溶液、②H2S溶液、③FeBr2溶液中:
(1)如果要将①中反应后的单质氧化产物从水溶液中分离,需先进行_________(填操作名称),然后进行分液即可;
(2)溶液②中出现淡黄色的沉淀,且反应后溶液呈强酸性,试写出反应的化学方程式__________________________________________________________________;
(3)反应③进行一段时间后振荡,溶液呈黄色,罗同学提出溶液变色的原因可能生成Br2 或Fe3+,请问他该如何通过实验确认生成Br2(限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硝酸银溶液、淀粉—碘化钾溶液)__________________;如果生成的是Fe3+,请写出反应的离子方程式:________________________________;
(4)已知:
Ⅰ.氧化性Cl2>HIO3>Br2>Fe3+>I2
Ⅱ.2Fe3++2I-=2Fe2++I2
将FeBr2、FeI2和HBr(强酸)溶于水,往溶液中通入过量Cl2,各反应或生成的微粒随氯气通入量的变化如下图所示
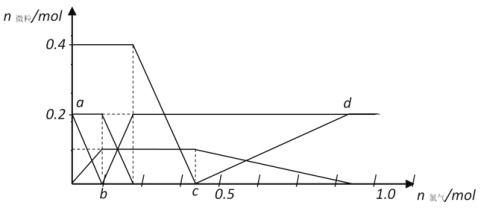
请回答:
①通过实验如何证明ab段反应已开始进行_____________________________;
②c点之前溶液中的阴离子总物质的量最大时为____________mol;
③cd段发生反应的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
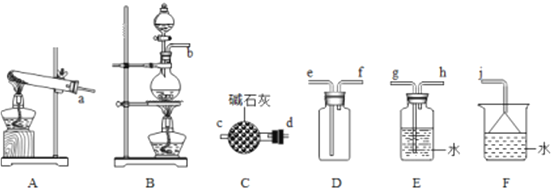
(1)氨气的制备
①用A装置可制备哪些常见气体_________,工业上制取氨气的化学方程式为____________。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应
将上述收集到的NH3充入注射器X中,向硬质玻璃管Y中加入少量催化剂并充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量无色液珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com