
分析 电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等.
非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等.
物质导电的条件:存在自由电子或者自由移动的离子.
解答 解:①KCl晶体在水溶液中或熔融状态下能导电的化合物,是电解质,本身不含自由电子或者自由移动的离子,不导电;
②液态HCl在水溶液中能导电的化合物,是电解质,本身不含自由电子或者自由移动的离子,不导电;
③熔融NaCl 在水溶液中或熔融状态下能导电的化合物,是电解质,本身含有自由移动的离子而导电;
④蔗糖在水溶液中和熔融状态下不能导电的化合物,属于非电解质;本身不含自由电子或者自由移动的离子,不导电;
⑤铜是单质,既不是电解质,也不是非电解质;含有自由电子能够导电;不溶于水;
⑥CO2本身不能电离产生自由移动的离子而导电,属于非电解质,溶于水能与水反应生成电解质碳酸,碳酸电离产生自由移动的离子而导电,所以二氧化碳水溶液能导电;
所以(1)以上物质能导电的是③⑤;
(2)以上物质属于电解质的是①②③;
(3)以上物质属于非电解质的是④⑥;
(4)以上物质中,溶于水能够导电的是①②③⑥;
故答案为:(1)③⑤;(2)①②③; (3)④⑥;(4)①②③⑥;
点评 本题考查了电解质、非电解质的判断,溶液导电性判断,熟悉电解质、非电解质的概念及物质类别是解题关键,注意单质、混合物既不是电解质也不是非电解质,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度,W 的体积分数减小,△H 增大 | |
| B. | 以 Y 的浓度变化表示的反应速率为 0.01 mol/(L•s) | |
| C. | 在其它条件不变的情况下,增加 1 mol X,则 X 和 Y 的转化率均提高 | |
| D. | 再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X、Y 的转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| B-A | B-D | B=D | A-A | A-D |
| 413.4 | 351 | 745 | 436 | 462.8 |
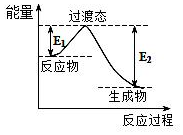
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(-CH3)所含有的电子数是9NA | |
| B. | 7.8g 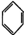 中含有的碳碳双键数为0.3NA 中含有的碳碳双键数为0.3NA | |
| C. | 1mol C2H5OH和1mol CH3CO18OH反应生成水的中子数为8NA | |
| D. | 标准状况下,11.2L己烷所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3 | B. | MgO | C. | SiO2 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和甲苯中都含有甲基,甲苯可以被酸性KMnO4溶液氧化成苯甲酸,而乙烷不能被其氧化,说明苯环对侧链产生了影响 | |
| B. | 苯和浓硝酸、浓硫酸混合物在100~110℃才能生成二硝基苯,而甲苯在100℃时即可生成三硝基甲苯,说明甲基对苯环产生了影响 | |
| C. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 | |
| D. | 除去苯中混入的少量甲苯可加入适量的酸性KMnO4溶液,充分反应后再加入足量的NaOH溶液,然后分液即可 |
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
将1.52 g铜镁合金完全溶解于50 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体 1120 mL(标准状况),向反应后的溶液中加入1.0 mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是1∶2
B.该浓硝酸中HNO3的物质的量浓度是14.0 mo l·L-1
l·L-1
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是640 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com